1、选择题 下列顺序表述正确的是( )
A.酸性:H3PO4>HNO3>HClO4
B.稳定性:H2O>HF>H2S
C.原子半径:Na>Mg>O
D.还原性:F->Cl->S2-
参考答案:A.非金属性:Cl>N>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则HClO4>HNO3>H3PO4,故A错误;
B.非金属性:F>O>S,元素的非金属性越强,对应的氢化物越稳定,则稳定性:HF>H2O>H2S,故B错误;
C.同周期元素从左到右元素的原子半径逐渐减小,则Na>Mg,原子核外电子层数越多,半径越大,则最小的为O,所以原子半径:Na>Mg>O,故C正确;
D.非金属性:F>Cl>S,元素的非金属性越强,对应的阴离子的还原性越弱,则还原性:F-<Cl-<S2-,故D错误.
故选C.
本题解析:
本题难度:一般
2、简答题 现有下列短周期元素性质的有关数据:
| 元素编号 | ?a | b | ?c | d | e | f | g | h | i | j
原子半径/pm
111
77
70
104
143
99
117
186
160
64
最高化合价或
最低化合价
+2
-4
-3
+6
+3
-1
+4
+1
+2
-1
|
(1)根据元素周期律确定a至j十种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内.
主族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
1
|
2
______
______
______
______
3
______
______
______
______
______
______
|
(2)上述10种元素形成的氢化物中,分子间存在氢键的有(填氢化物的化学式)______.
(3)i在b的氧化物中燃烧的方程式为______.
(4)h和d所形成的化合物的电子式为______.
(5)原子数相同,电子总数相同的分子或离子互称等电子体.在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,画出“白石墨”的最小结构单元的结构式______.
参考答案:(1)、根据短周期元素、元素周期律确定a至j十种元素在周期表中的位置.根据主族元素的最高价=其族序数=价电子数,主族元素的最低负价=其族序数-8)判断,a至j十种元素在周期表分别属于ⅡA、ⅣA、ⅤA、ⅥA、ⅢA、ⅦA、ⅣA、ⅠA、ⅡA、ⅦA.再根据同一主族,元素的原子半径随着原子序数的增大而增大,a至j十种元素属于第二周期的为:a、b、c、j,属于第三周期的为:h、i、e、g、d、f.所以本题的答案为:
主族
周期ⅠAⅡAⅢAⅣAⅤAⅥAⅦA012abcj3hiegdf(2)、形成氢键的分子,既要有较易提供H原子的分子,还要具有孤电子对,而且电负性比较强、原子半径又不太大的原子作为电子对的供体.因此,可以具有较强氢键的元素是F、O、N三种元素,本题中只有F、N元素,所以本题的答案为:
HF、NH3.
(3)、通过(1)题确定i为Mg 元素,b是C元素,C的氧化物是CO2,Mg能够在CO2中燃烧,产物是白色的固体MgO和黑色的固体C,所以本题的答案为:2Mg+CO2 ?点燃?.?2MgO+C.
(4)、通过(1)知道,h处于第三周期第一ⅠA族是Na元素,d处于第三周期第ⅥA族是S元素,Na元素与S元素形成的化合物为离子化合物,形成的键位离子键.书写时原子少的放中间,原子多的放周边,阳离子只写元素符号,右上角标出电荷和电性,阴离子要有中括号括起来,然后在右上角标出电荷和电性,所以本题答案为:
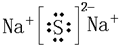
(5)、石墨晶体是层面结构的,每个C为三个正六边形共用,每六个C原子形成一个正六边形,碳相邻的N、B两种元素可形成具有石墨型晶体结构,所以白石墨的最小结构单元的结构式为:正六边形,且三个N原子三个B原子相互间隔分布在每个顶点上
.
本题解析:
本题难度:一般
3、填空题 下表是元素周期表中第一、第二周期10种元素的某种性质的一组数据(所列数据的单位是相同的)。除“……”的五种元素外,其余元素都给出了该种元素的全部该类数据。研究这些数据,回答下列问题

(1)每组数据可能是该元素的_______(填序号)
A.原子得到电子所放出的能量
B.原子半径的大小
C.原子逐个失去电子所吸收的能量
D.原子及形成不同分子的半径的大小
(2)分析同周期自左向右各元素原子的第一个数据:
①总体变化趋势是________(填“增大”或“减小”);
②与前后元素相比,由于该元素的数值增大较多而变得反常的元素位于元素周期表的某些族,分析它们的原子核外电子排布,指出造成上述反常情况的可能原因是______(填序号)。
A.它们的原子半径突然变小些
B.它们的核外电子排布处于饱和状态
C.它们的原子半径突然变大些
D.电子填充时,某些原子轨道达到半充满或全满时,体系稳定性提高
根据以上规律,请推测镁和铝的第一个数据的大小关系为:Mg(1)____Al(1)(填“>”或“<”或“=”)。
(3)每种元素的一组数据中个别地方增大的比例特别大,形成突跃(大幅度增大),请找出这些数据,并根据这些数据出现的规律,你认为氧元素出现该情况的数据应该是氧元素8个数据中的第______个。上述规律可以证明原子结构中____________________的结论。
参考答案:(1)C
(2)①增大;②D;>
(3)七;核外电子是分层排布
本题解析:
本题难度:一般
4、选择题 下列各组变化规律不正确的是
A.稳定性:HF>HCl>HBr>HI
B.酸性:HClO4>H2SO4 >H3PO4
C.离子半径:N3->O2->F->Na+>Mg2+
D.沸点:F2> Cl2> Br2> I2
参考答案:D
本题解析:第ⅦA元素自上而下单质的沸点逐渐升高,选项D不正确,其余都是正确的,答案选D。
本题难度:困难
5、选择题 根据元素周期表和元素周期律分析下面的推断,其中正确的是( )
A.钾与水反应较钠与水反应更为剧烈
B.硒(Se)化氢比硫化氢稳定
C.氢氧化镁的碱性比氢氧化钡的碱性强
D.N、O、F原子半径依次增大
参考答案:A.钾比水钠活泼,则钾与水反应较钠与水反应更为剧烈,故A正确;
B.Se比S的非金属性弱,则硫化氢比硒化氢稳定,故B错误;
C.Ba的金属性比Mg强,则氢氧化钡的碱性比氢氧化镁强,故C错误;
D.同周期元素从左到右原子半径逐渐减小,故D错误.
故选A.
本题解析:
本题难度:一般