1、选择题 属于定量仪器的是
A.试管
B.烧杯
C.量筒
D.锥形瓶
参考答案:C
本题解析:图中试管和烧杯、锥形瓶可做反应容器,量筒是量度液体药品体积的,所以涉及定量的问题的仪器的是量筒.故C选项正确。
本题难度:简单
2、选择题 下列实验操作中,正确的是?
A.配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解
B.蒸馏操作时,应将温度计插入烧瓶中的溶液中
C.测溶液的pH时,将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
D.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出
参考答案:A
本题解析:蒸馏操作时,应将温度计插入烧瓶的支管出口处,B不正确。C不正确,应该用玻璃棒蘸取待测液点在试纸上。分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体从上口倒出,D不正确,因此正确的答案选A。
本题难度:简单
3、填空题 重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
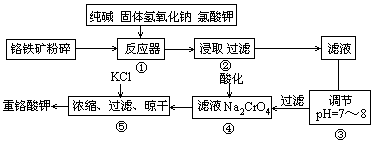
(1)碱浸前将铭铁矿粉碎的作用是?
(2)步骤③调节pH后过滤得到的滤渣是?。
(3)操作④中,酸化时,CrO2- 4转化为Cr2O2- 7,写出平衡转化的离子方程式
?;
(4)用简要的文字说明操作⑤加入KCl的原因?。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O2- 3=2I- +S4O2- 6)
①判断达到滴定终点的依据是?;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)?(保留2位有效数字)。
参考答案:(14分)
(1)增大接触面积,增大反应速率(2分)
(2)Al(OH)3、H2SiO3(2分)
(3)2 CrO2- 4+2H+ Cr2O2- 7+H2O(2分)
Cr2O2- 7+H2O(2分)
(4)温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应,可得到重铬酸钾(2分)
(5)①当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪色(2分)②94.08 %(2分)
本题解析:
(1)将铭铁矿粉碎的作用是增大接触面积,增大反应速率;
(2)根据工艺流程图中可以看出在反应器中SiO2、Al2O3与NaOH反应分别转化为Na2SiO3和NaAlO2, 步骤③调节pH后过滤得到的滤渣是Al(OH)3、H2SiO3;
(3)酸化时,CrO2- 4转化为Cr2O2- 7平衡转化的离子方程式为2CrO2- 4+2H+ Cr2O2- 7+H2O;
Cr2O2- 7+H2O;
(4)结合题中信息温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应,降温结晶时得到的是重铬酸钾。
(5)检测碘单质存在可用淀粉,直到蓝色褪去;分析可得关系式:Cr2O2- 7~3I2~6S2O2- 3,n(S2O2- 3)=0.04L×0.12mol/L,而25ml中1/6n(S2O2- 3)= n(Cr2O2- 7)=0.0008mol,则250ml中含有的m(K2Cr2O7)=0.0008mol×10×294g/mol=2.352g,可知质量分数为2.352g/2.500g×100%=94.08%。
本题难度:困难
4、选择题 下列实验方法:①用渗析法分离蛋白质和葡萄糖的混合液?②用盐析法分离出皂化反应产生的高级脂肪酸钠?③用蒸馏法分离C2H5OH与H2O的混合物?④用分液法分离H2O和C2H5Br的混合物。你认为上述方法(?)
A.只有①不正确
B.②③不正确
C.只有③④正确
D.全部正确
参考答案:D
本题解析:①中蛋白质溶液是一种胶体,而葡萄糖溶液不是,可用渗析法进行分离;②中向混合液中加入食盐使高级脂肪酸钠的溶解度降低而析出从而达到分离的目的;③中乙醇和水的沸点不同,可用蒸馏法分离;④中溴乙烷密度比水大,难溶于水,可用分液法进行分离。
本题难度:一般
5、选择题 下列基本操作正确的是
[? ]
A.手持试管给试管里的物质加热
B.用燃着的酒精灯去点燃另一盏酒精灯
C.用天平称取药品时用手直接拿砝码
D.用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁
参考答案:D
本题解析:
本题难度:简单