1、选择题 氯化铜在水溶液中存在有如下平衡:
〔Cu(H2O)4〕2+(蓝色)+4Clˉ 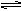 ?〔CuCl4〕2ˉ(绿色)+4H2O 下列操作可以使溶液变蓝色的是:
?〔CuCl4〕2ˉ(绿色)+4H2O 下列操作可以使溶液变蓝色的是:
A.向溶液中加入少量NaCl晶体
B.向溶液中滴加少量浓盐酸
C.向溶液中滴加少量AgNO3溶液
D.加水将溶液稀释
参考答案:CD
本题解析:略
本题难度:一般
2、选择题 将一定量A、B装入容积为1L的恒温密闭容器中,发生反应:2A(s)+bB(g)?cC(g),1min时达到平衡,C的浓度为x mol?L-1.若保持温度不变,将密闭容器的容积压缩为原来的
,重新达到平衡后,C的浓度为2.5xmol?L-1.下列说法正确的是( )
A.化学计量数的关系:b<c
B.容器的容积减小后,该反应的逆反应速率减小
C.若保持温度和容器的容积不变,充入氦气(不参与反应),平衡不发生移动
D.原容器中用B的浓度变化表示该反应在1min内的速率为mol?L-1?min-1
参考答案:反应2A(s)+bB(g)?cC(g),1min时达到平衡,C的浓度为x mol?L-1.若保持温度不变,将密闭容器的容积压缩为原来的12,重新达到平衡后,C的浓度为2.5xmol?L-1,则体积缩小时压强增大,C的浓度大于2xmol/L,即增大压强,化学平衡正向移动,
A.增大压强,化学平衡向气体体积缩小的方向移动,所以2+b>c,b、c的关系不确定,故A错误;
B.容器的容积减小后,反应物的浓度增大,压强增大,所以该反应的逆反应速率增大,故B错误;
C.若保持温度和容器的容积不变,充入氦气(不参与反应),反应体系中各物质的浓度不变,平衡不移动,故C正确;
D.1min时达到平衡,C的浓度为x mol?L-1,v(C)=xmol?L-1?min-1,由反应速率之比等于化学计量数之比可知,v(B)=bxcmol?L-1?min-1,故D错误;
故选C.
本题解析:
本题难度:一般
3、选择题 在反应3H2+N2 2NH3,经一段时间后,氨的浓度增加了0.6 mol/L,在此时间内用H2表示的平均反应速率为0. 45 mol/(L·s),则反应所经历的时间为?
2NH3,经一段时间后,氨的浓度增加了0.6 mol/L,在此时间内用H2表示的平均反应速率为0. 45 mol/(L·s),则反应所经历的时间为?
[? ]
A.0.44 s
B.1 s
C.0.33 s
D.2 s
参考答案:D
本题解析:
本题难度:简单
4、选择题 在一定温度下,将1 mol N2和3 mol H2放入恒容密闭容器中,达到平衡时,测得NH3为0.8 mol,如果此时再加入1 mol N2和3 mol H2,达到新平衡时,NH3的物质的量(?)
A.等于8 mol
B.等于1.6 mol
C.大于0.8 mol小于1.6 mol?
D.大于1.6 mol
参考答案:D
本题解析:略
本题难度:一般
5、简答题 把0.6mol?X气体和0.6mol?Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nZ(g)+2W(g).2min?末已生成0.2mol?W,若测知以Z的浓度变化表示的反应速率为0.1mol?L-1?min-1,请计算:
(1)2min末时Y的浓度.
(3)化学反应方程式中n的值是多少?
(2)前2min内用X的浓度变化表示的平均反应速率.
参考答案:利用三段式法计算:
?2X(g)+Y(g)=nZ(g)+2W(g)
起始:0.6mol? 0.6mol?0? 0
转化:0.2mol? 0.1mol? 0.1nmol 0.2mol
平衡:0.4mol?0.5mol? 0.1nmol?0.2mol?
(1)平衡时Y的物质的量为0.5mol,则c(Y)=0.5mol2L=0.25mol/L,
答:2min末时Y的浓度为0.25?mol?L-1;
(2)v(W)=0.2mol2L2min=0.05mol/(L?min),c(Z)=0.1mol/(L?min),
由反应速率之比等于化学计量数之比可知:n:2=0.1mol/(L?min):0.05mol/(L?min),n=4,
答:化学反应方程式中n=4;
(3)由反应速率之比等于化学计量数之比可知:v(X)=v(W)=0.05mol/(L?min),
答:前2min内X的平均反应速率为0.05?mol?L-1?min-1.
本题解析:
本题难度:一般