|
高考化学知识点归纳《物质的量》试题强化练习(2019年最新版)(六)
2019-05-30 05:11:35
【 大 中 小】
|
1、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4L苯的分子数约为NA个
B.常温下,在18g18O2中含有NA个氧原子
C.标准状况下,17g NH3所含共价键数为NA个
D.1mol Na2O2中含有的阴离子数目为2NA个
|
参考答案:B
本题解析:在标准状况下,苯不是气体,A不正确。18g18O2的物质的量是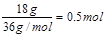 ,所以含有的氧原子是1mol,B正确。氨气中含有3个N-H单键,17g氨气是1mol,所以含有的共价键是3mol,C不正确。过氧化钠中的阴离子是O22-,即阴离子和阳离子的个数之比是1 ,所以含有的氧原子是1mol,B正确。氨气中含有3个N-H单键,17g氨气是1mol,所以含有的共价键是3mol,C不正确。过氧化钠中的阴离子是O22-,即阴离子和阳离子的个数之比是1
本题难度:困难
2、填空题 实验室用固体烧碱配制500mL?1mol/L的NaOH溶液.
(1)需称量______g的烧碱固体,固体应放在______中称量.
(2)配制过程中除了烧杯还需要哪些仪器________________________
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低或无影响)
①定容时俯视刻度线______?②容量瓶未干燥______③转移过程中有少量液体溅出______④未洗涤烧杯和玻璃棒______
(4)若定容时液面高于刻度线应采取的措施是______.
参考答案:(1)实验室配制500mL?1mol/L的NaOH溶液需要NaOH的质量为:0.5L×1mol/L×40g/mol=20.0g,固体应放在小烧杯 中称量,故答案为:20.0;小烧杯;
(2)配制顺序是:计算→称量→溶解、冷却→移液→定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:托盘天平、药匙、玻璃棒、500mL容量瓶、胶头滴管;
(3)①定容时俯视刻度线,溶液的液面低于刻度线,溶液的体积偏小,浓度偏高,故答案为:偏高;
②容量瓶未干燥,对溶液的体积无影响,浓度不变,故答案为:无影响;
③转移过程中有少量液体溅出,溅出的液体中含有溶质溶质的质量偏小,浓度偏低,故答案为:偏低;
④未洗涤烧杯和玻璃棒,涤烧杯和玻璃棒沾有溶质,,溶质的质量偏小,浓度偏低,故答案为:偏低;
(4)实验操作出现加蒸馏水时不慎超过了刻度,则溶液的浓度偏小,应重新配制,故答案为:重新配制.
本题解析:
本题难度:一般
3、选择题 有BaCl2和NaCl的混合溶液w L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加 AgNO3溶液,使Cl-离子完全沉淀。反应中消耗a mol H2SO4、b mol AgNO3。据此得知原混合溶液中的
c(Na+) mol/L为
[? ]
A.(b-2a)/w
B.(b-a)/w
C.(2b-2a)/w
D.(2b-4a)/w
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列关于0.5 mol·L-1Ba(NO3)2溶液叙述中,不正确的是:
A.1L溶液中所含阴阳离子总数是1.5NA个
B.1L溶液中含0.5NA个NO3—
C.500mL溶液中NO3—的浓度是0.5 mol·L-1
D.500mL溶液中含 0.5NA个NO3—
参考答案:BC
本题解析:A正确;B错,1L溶液中含NA个NO3—;C错,500mL溶液中NO3—的浓度是1 mol·L-1;D正确;
本题难度:简单
5、选择题 用已准确称量过的氯化钠固体配成100ml1mol/l的氯化钠溶液,需要用到下列仪器中的( )
①坩埚②分液漏斗③100ml容量瓶④烧瓶⑤胶头滴管⑥烧杯⑦玻璃棒⑧托盘天平.
A.③④⑤⑧
B.①②④⑧
C.③⑤⑥⑦
D.①③⑥⑦
参考答案:称量完氯化钠后,需要使用烧杯和玻璃棒溶解氯化钠,然后将溶解的氯化钠溶液沿着玻璃棒转移到100mL容量瓶中,再直接加水定容,加水到距离容量瓶刻度线1-2cm时,改用胶头滴管进行定容,所以还需要的仪器有:③100ml容量瓶⑤胶头滴管⑥烧杯⑦玻璃棒,
故选C.
本题解析:
本题难度:简单
|