1、简答题 某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如右(写出最佳答案)
(1)沉淀的化学式:
沉淀1______
沉淀2______
沉淀3______
(2)写出混合液+A的离子方程式______
写出溶液+B的离子方程式______.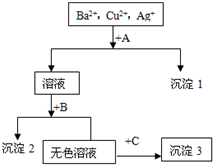
参考答案:(1)溶液含有Ba2+、Cu2+、Ag+,应先加入HCl,生成AgCl沉淀,过滤后在加入Na2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,所以沉淀1是氯化银,沉淀2是氢氧化铜,沉淀3是硫酸钡,故答案为:AgCl;Cu(OH)2;BaSO4;
(2)混合液+A反应的离子方程式为Ag++Cl-=AgCl↓,沉淀2为Cu(OH)2,溶液+B反应的离子方程式为:Cu2++2OH-=Cu(OH)2↓,
故答案为:Ag++Cl-=AgCl↓;Cu2++2OH-=Cu(OH)2↓.
本题解析:
本题难度:一般
2、实验题 高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下:
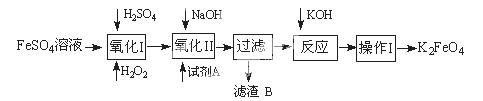
查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定
②溶解度很大,难溶于无水乙醇等有机溶剂
③具有强氧化性,能氧化有机烃、苯胺和80%以下乙醇溶液
回答下列问题:
(1)写出“氧化I”中,生成Fe3+的离子反应方程式?。
(2)氧化II中,试剂A为? (填“H2O2”或“HNO3”或“NaClO”);过滤操作中,得到的滤渣B中除NaCl还有?
(3)操作I中包括冷却结晶、过滤、洗涤干燥几个步骤。洗涤干燥的目的是脱碱脱水,进行该操作时最好用?洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式:?K2FeO4 + ??H2O = ?Fe(OH)3↓ + ?KOH + ??
(5)将一定量的K2FeO4投入一定浓度的FeCl3溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是?。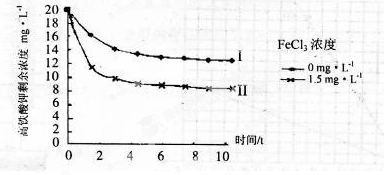
参考答案:(16分)
(1)H2O2+2H++2Fe2+=2Fe3++2H2O(3分,配平错扣1分)
(2)NaClO? Na2SO4(各2分,共4分)
(3)无水乙醇(3分)
(4)4? 10? 4? 8? 3O2 ↑?(产物正确1分,共3分)
(5)FeCl3溶液水解显酸性,促进K2FeO4与水反应,从而降低K2FeO4浓度(3分)
本题解析:(1)原料为硫酸亚铁溶液,所含亚铁离子具有还原性,硫酸是强酸,提供氢离子,不仅能抑制亚铁离子和铁离子的水解,而且能增强过氧化氢的氧化能力,使亚铁离子氧化为铁离子,根据化合价升降法、电荷守恒、原子守恒配平,则氧化I中生成铁离子的离子方程式为H2O2+2H++2Fe2+=2Fe3++2H2O;(2)由于目标产物是K2FeO4,它在碱性环境中稳定,在中性和酸性条件下不稳定,则氧化II中加入的氧化剂不能使H2O2,因为H2O2在碱性条件下的氧化性比酸性条件下弱,试剂A也不能是HNO3,因为酸性条件下Na2FeO4不稳定,试剂A只能是 NaClO,氧化II中反应为2NaOH+H2SO4=Na2SO4+2H2O、Fe2(SO4)3+3NaClO+10NaOH==2Na2FeO4+3NaCl+3Na2SO4+5H2O;根据已知信息可知,K2FeO4的溶解度很大,由此类推Na2FeO4的溶解度很大,为了从Na2FeO4、NaCl、Na2SO4、NaClO(过量)、NaOH(过量)组成的混合溶液中分离出Na2FeO4、NaOH(过量),则过滤所得滤渣的主要成分为NaCl、Na2SO4、NaClO(过量),除去它们之后所得的Na2FeO4、NaOH(过量)溶液用于制备K2FeO4;(3)Na2FeO4、NaOH(过量)溶液中加入过量KOH时的反应为:Na2FeO4+2KOH= K2FeO4+2NaOH,所得溶液经过蒸发浓缩、冷却结晶、过滤、洗涤可得K2FeO4晶体;由于K2FeO4的溶解度很大,难溶于无水乙醇等有机溶剂,且具有强氧化性,能氧化有机烃、苯胺和80%以下乙醇溶液,除去碱的同时,为了减少洗涤晶体造成K2FeO4的损失,最好选择无水乙醇洗涤K2FeO4晶体;(4)观察可得,该反应中铁元素由+6价将为+3价,钾元素、氢元素的化合价都没有变化,根据氧化还原反应的特征推断,化合价升高的元素只能是氧,氧元素由—2价升为其相邻的0价,则缺项物质为氧气,根据化合价升降法、原子守恒配平可得:4K2FeO4+10H2O==4Fe(OH)3↓ +8KOH+3O2↑;(5)根据已知信息可知,K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定,氯化铁是强酸弱碱盐,能水解,导致其溶液显弱酸性,K2FeO4在酸性条件下不稳定,酸性越强,K2FeO4越不稳定,反应速率越大,剩余K2FeO4的浓度越小。
本题难度:困难
3、选择题 离子方程式H++OH-=H2O可表示的化学反应是
[? ]
A.盐酸与氢氧化铜的反应
B.硫酸与氢氧化钠的反应
C.硫酸与氢氧化钡的反应
D.盐酸与氨水的反应
参考答案:B
本题解析:
本题难度:简单
4、选择题 用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应,符合离子方程式2H++SO32-=H2O+SO2↑的反应个数有
A.4个
B.5个
C.8个
D.12个
参考答案:C
本题解析:化学方程式仅表示一定物质间的某个反应,而两离子方程式表示了所所有同一类的反应。用上述物质发生的化学反应有(1)硝酸+亚硫酸钠=硝酸钠+水+二氧化硫;(2)硝酸+亚硫酸钾=硝酸钾+水+二氧化硫;(3)硫酸+亚硫酸钠=硫酸钠+水+二氧化硫;(4)硫酸+亚硫酸钾=硫酸钾+水+二氧化硫;(5)盐酸+亚硫酸钾=氯化钾+水+二氧化硫;(6)盐酸+亚硫酸钠=氯化钠+水+二氧化硫;(7)硫酸氢钠+亚硫酸钠=硫酸钠+水+二氧化硫;(8)硫酸氢钾+亚硫酸钾=硫酸钾+水+二氧化硫;因为亚硫酸钡难容,不能写成SO32-形式,所以无钡盐。正确选项为:C。
本题难度:一般
5、选择题 下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是
[? ]
化学反应?
离子方程式?
评价?
A
碳酸钙与醋酸反应
CO32- +2CH3COOH= CO2↑+H2O+2CH3COO-
错误。碳酸钙是弱电解质,不应写成离子形式
B
苯酚钠溶液中通入少量CO2
2C6H5O-+CO2+H2O→ CO32- +2C6H5OH
正确
C
NaHSO3的水解
HSO3-+H2O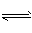 SO32- +H3O+
SO32- +H3O+
错误。水解方程式误写 成电离方程式
D
等物质的量的FeBr2和Cl2反应
2Fe2+ +2Br-+2Cl2= 2Fe3++Br2+4Cl-
错误。Fe2+与Br-的物质的量之比与化学式 不符
参考答案:C
本题解析:
本题难度:一般