| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《离子方程式的书写及正误判断》高频试题巩固(2019年最新版)(四)
参考答案:B 本题解析:离子方程式书写的正误判断方法和步骤归纳如下,简称“十看”。一看离子方程式是否符合客观事实;二看发生的反应能否用离子方程式表示;三看各物质拆写成离子的时候拆写是否正确;四看生成物中的“↑”和“↓”是否标注正确;五看离子方程式左右两边电荷是否守恒、质量是否守恒;六看操作顺序;七看是否漏写离子反应;八看离子的配比是否符合事实;九看过量或少量的反应物是否对产物有影响;十看氧化还原型离子反应是否遵循电子守恒。B项属于漏写离子反应,漏掉了Cu2+和OH-的反应,正确书写为:Ba2++2OH-+Cu2++SO 本题难度:困难 2、选择题 下列离子方程式正确的是 |
参考答案:B
本题解析:A.向澄清石灰水中加入等物质的量的NaHCO3溶液生成碳酸钙、氢氧化钠和水,离子方程式错误,A错误;B.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全生成硫酸钡、一水合氨和水,离子方程式正确,B正确;C.氢氧化铁溶于氢碘酸中发生氧化还原反应生成碘化亚铁、碘和水,离子反应为2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O,C错误;D.产生沉淀的物质的量达最大值,钡离子、铝离子均转化为沉淀,则离子反应为2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓,故D错误,答案选B。
考点:考查离子方程式的正误判断
本题难度:一般
3、选择题 能正确表示下列反应的离子方程式是
A.钠投入水中:Na+H2O=Na++OH-+H2↑
B.碳酸钙与醋酸反应:CO32-+2CH3COOH===CO2↑+H2O+2CH3COO-
C.少量碳酸氢钙溶液与足量氢氧化钠溶液反应:Ca2+ + HCO3-+ OH-= CaCO3 ↓ + H2O
D.铜片插入硝酸银溶液中:Cu +2Ag+= Cu2++2Ag
参考答案:D
本题解析:A.电荷不守恒,钠投入水中离子方程式是:2Na+2H2O=2Na++2OH-+H2↑,错误;B.碳酸钙是难溶性的物质,应该写化学式, CaCO3+2CH3COOH===Ca2++CO2↑+H2O+2CH3COO-,错误;C.少量碳酸氢钙溶液与足量氢氧化钠溶液反应应该以碳酸氢钙为标准:Ca2+ + 2HCO3-+ 2OH-= CaCO3 ↓ + H2O + CO32-,错误;D.反应符合事实,拆写也符合离子方程式的原则,正确。
考点:考查离子方程式书写的正误的的知识。
本题难度:一般
4、填空题 (10分)如下图所示,烧杯中都盛有稀硫酸。
(1)中反应的离子方程式为  ,
,
(2)中的电极反应:Fe: 、Sn:
Sn极附近溶液的pH(填增大、减小或不变)
(3)中被腐蚀的金属是 。
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是 (用序号回答)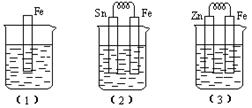
参考答案:(10分 ) (1)Fe + 2H+ = Fe2+ + H2↑
) (1)Fe + 2H+ = Fe2+ + H2↑
(2)Fe + 2e- = Fe2+ 2H+ + 2e- = H2↑ 增大 (3) Zn (2)(1)(3)
本题解析:略
本题难度:一般
5、填空题 (9分)(1)向某溶液中加入KSCN溶液无明显现象,再滴入数滴氯水后,溶液立即变成红色,则原溶液中一定含有________离子,要除去FeCl3溶液中少量的氯化亚铁,可行的办法是________(填字母)。
A.加入铜粉 B.加入铁粉 C.通入氯气 D.加入KSCN溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式 。
(2)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,写出FeCl3与金属铜反应的离子方程式 。
(3)使用过的腐蚀液会失效,但可以回收利用,某兴趣小组为了从使用过的腐蚀液中回收铜,应使用的试剂是________(填字母)。
A.铜粉 B.氯气 C.铁粉 D.KSCN溶液
(4)向沸水中逐滴滴加1 mol·L-1FeCl3溶液至液体呈透明的红褐色,该分散系中微粒直径的范围是____nm,区别该液体和FeCl3溶液可用 方法。
参考答案:(1) Fe2+ C 2Fe2++Cl2=2Fe3++2Cl- (2)2Fe3++Cu=2Fe2++Cu2+ (3)C (4) 1~100
丁达尔效应
本题解析:
试题解析:(1)铁离子Fe3+,可以在溶液中加入硫氰酸钾溶液,溶液变为血红色,证明是含有三价铁离子;某溶液中加入KSCN溶液无明显现象,再滴加氯水,溶液立即变为血红色,说明原溶液含有亚铁离子,加入氯水发生反2Fe2++Cl2=2Fe3++2Cl-,生成的铁离子和硫氰酸根离子生成血红色溶液;要除去FeCl3溶液中少量的氯化亚铁,可行的办法是加入氧化剂,但不引入新的杂质,即通入氯气,对应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;(2)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,对应的离子方程式为Cu+2Fe3+=2Fe2++Cu2+;(3)从使用过的腐蚀液中含铜离子,回收铜,可利用金属单质之间的置换反应,选项中只有铁粉能置换出Cu;(5)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,生成氢氧化铁胶体,胶体的微粒直径的范围是1~100nm,区分胶体和FeCl3溶液可以通过丁达尔现象(效应),氢氧化铁胶体具有光亮的通路。
考点:铁及其化合物的性质
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《与量有关的.. | |