1、计算题 (6分)Ⅰ.取1.43g Na2CO3·XH2O 溶于水配成10ml 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0ml,并收集到112ml CO2(标况)。
(1)稀盐酸物质的量浓度为___________。
(2)Na2CO3·xH2O的摩尔质量为___________。
(3)x=_______。
Ⅱ.在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,化学方程式是:
2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(1)用“双线桥”标出电子转移的方向和数目。
(2)反应产物中,氧化产物与还原产物的物质的量之比为 。
参考答案:Ⅰ. (1)5 mol·L-1(2)286g·mol-1(3)10;Ⅱ.(1)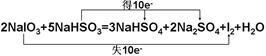
(2)5:1(1分)
本题解析:Ⅰ.(1)n(CO2)=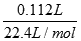 =0.005mol,
=0.005mol,
Na2CO3 + 2HCl = 2NaCl+CO2↑+H2O
1 2 1
n(Na2CO3) n(HCl) 0.005mol
(1)n(HCl)=2×n(CO2)=2×0.005mol=0.01mol,c(HCl)=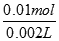 =5.0mol/L,故答案为:5.0mol/L;(2)n(Na2CO3?xH2O)=n(Na2CO3)=0.005mol,M(Na2CO3?xH2O)=286g/mol,故答案为:286g/mol; (3)由摩尔质量可知:106+18x=286,x=10,故答案为:10.
=5.0mol/L,故答案为:5.0mol/L;(2)n(Na2CO3?xH2O)=n(Na2CO3)=0.005mol,M(Na2CO3?xH2O)=286g/mol,故答案为:286g/mol; (3)由摩尔质量可知:106+18x=286,x=10,故答案为:10.
Ⅱ.(1)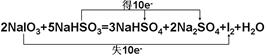
(2)反应中S元素的化合价升高,则S元素失去电子被氧化,生成硫酸钠,I元素的化合价降低,则NaIO3为氧化剂,由化合价变化可知生成1mol氧化产物转移2mol电子,生成1mol还原产物,转移10mol电子,根据转移电子数守恒知,氧化产物与还原产物的物质的量比为5:1.
考点:氧化还原反应
本题难度:一般
2、选择题 设NA为阿伏加德罗常数的数值,下列说法中正确的是
A.标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA
B.常温下,l L pH=l的H2SO4溶液中含有的H+的数目为0.2NA
C.标准状况下,2.24 L NH3中含有共价键的数目为NA
D.常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子
参考答案:D
本题解析:A、标准状况下22.4L氯气的物质的量=22.4L÷22.4L/mol=1.0mol,但氯气与水的反应是可逆反应,因此转移的电子数小于NA,A不正确;B、常温下,l L pH=l的H2SO4溶液中氢离子的浓度是0.1mol/L,所以含有的H+的数目为0.1NA,B不正确;C、氨气分子中含有3个N-H键,所以标准状况下,2.24 L NH3中含有共价键的数目为0.3NA,C不正确;D、NO2和N2O4的最简式相同,都是NO2,所以常温下,23 g NO2和N2O4的混合气体中含有的氧原子的物质的量=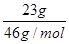 ×2=1mol,因此氧原子个数是 NA,D正确,答案选D。
×2=1mol,因此氧原子个数是 NA,D正确,答案选D。
本题难度:一般
3、填空题 将10.7g氯化铵固体与足量熟石灰混合加热,使之充分反应。
(1)写出反应的化学方程式: 。
(2)生成的氨气在标准状况下的体积是 L。
(3)若将这些氨气溶于水配成500mL氨水,该氨水的物质的量浓度是 mol·L-1。
(4)在400℃左右且有催化剂存在的情况下,用氨可以把一氧化氮还原成氮气,方程式为:4NH3+6NO=5N2+6H2O,此反应中氧化产物与还原产物的物质的量之比为 。
参考答案:(1)2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3↑(2)4.48L(3)0.4mol/L(4)2
CaCl2 + 2H2O + 2NH3↑(2)4.48L(3)0.4mol/L(4)2
本题解析:
本题难度:一般
4、选择题 下列物质中所含分子的物质的量最多的是
A.1.5 mol O2
B.56g N2
C.33.6LCl2(标准状况)
D.3.01×1023个SO2分子
参考答案:B
本题解析:略
本题难度:简单
5、选择题 由CaCO3和MgCO3组的混和物充分加热至质量不再减少时,称得残留的固体质量是原混和物的一半,则残留物中钙、镁两元素原子的物质的量之比是 ( )
A.1∶1
B.1∶2
C. 91EXAm.org1∶3
D.2∶1