1、填空题 在试管甲中加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.
(1)试管乙中盛放的溶液是______.
(2)写出乙醇与乙酸反应的化学方程式______.
(3)实验完成后,试管乙的液面上有透明的不溶于水的油状液体产生.若分离10mL该液体混合物需要用到的主要玻璃仪器是______,这种方法叫做______.
参考答案:(1)乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:饱和碳酸钠溶液;
(2)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,同时该反应可逆,反应的化学方程式为
CH3COOH+CH3CH2OH
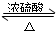
CH3COOC2H5+H2O;
故答案为:CH3COOH+HOCH2CH3

CH3COOCH2CH3+H2O;
(3)分离互不相溶的液体,应采取分液操作,常用的仪器是分液漏斗;
故答案为:分液漏斗,分液.
本题解析:
本题难度:一般
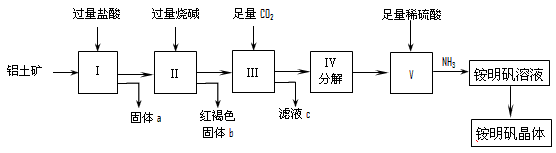
2、实验题 实验室中以铝土矿(主要成分是Al2O3和少量的SiO2和Fe2O3杂质)为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如下:
试回答下列问题:
⑴固体a的化学式为_____,III中通入过量CO2气体的离子方程式为____________ 。
⑵由V制取铵明矾溶液的化学方程式为_________________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________ 、冷却结晶、过滤洗涤。
⑶以1000kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84g/cm3)___________L(保留一位小数)。
⑷若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中Al2O3和H2SO4的物质的量之比为___________。
参考答案:⑴SiO2? ; AlO2-+CO2+2H2O ==HCO3-+Al(OH)3↓
⑵Al2(SO4)3 + H2SO4 + 2NH3 ==2NH4Al(SO4)2 ;?蒸发浓缩
⑶575.4L
⑷3:10
本题解析:
本题难度:一般
3、实验题 聚合硫酸铁又称聚铁,化学式为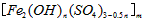 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下
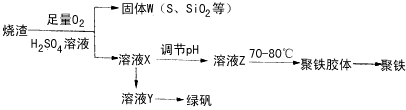
(1)验证固体W焙烧后产生的气体含有SO2的方法是_________________。
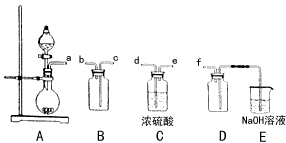
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,
①按气流方向连接各仪器接口顺序为a→_____→______→______→______→f
②装置D的作用是_________________,装置E中NaOH溶液的作用是______。
(3)制备绿矾时,向溶液X中加入过量______________,充分反应后,经_______操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为_____________。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏__________。
参考答案:(1)将气体通入品红溶液中,如品红褪色,加热后又变红,证明有SO2。
(2)①d、e、b、c;②安全瓶,防止倒吸;尾气处理,防止污染
(3)铁粉;过滤
(4)将试纸放到表面皿上,用玻璃棒蘸取溶液,点到试纸的中央,然后跟标准比色卡对比;低
本题解析:
本题难度:困难
4、实验题 在电子工业中利用镁制取硅的反应为2Mg+SiO2 2MgO+Si,同时会发生副反应:2Mg+ Si
2MgO+Si,同时会发生副反应:2Mg+ Si Mg2Si,
Mg2Si,
Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易自燃的气体。下图是进行
Mg与SiO2反应的实验装置。试回答下列问题
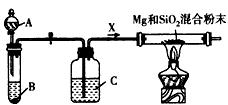
(1)由于O2和H2O(g)的存在对该实验有不良影响,实验中应通入X气体作为保护气。在A、B、C三种仪器中反应开始前的 试剂分别是:A__________,B__________,C_________(填序号)。
①稀硫酸 ②浓硫酸 ③稀盐酸 ④石灰石 ⑤纯碱 ⑥锌粒
(2)实验开始时,必须先通入X气体,再加热反应物,其理由是__________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是_______________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因用化学方程式表示为:①________________,②________________。
(4)这样制得的硅会混有杂质(如SiO2等)而称粗硅,有人设计了如下流程进行提纯:
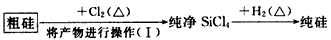
①操作(I)的名称是______________________ ②涉及的化学方程式为_______________________
参考答案:(1)①;⑥;②
(2)防止在加热条件下H2和O2混合发生爆炸;SiO2和Mg粉的反应是放热反应
(3)①Mg2Si+4HCl=2MgCl2+SiH4↑;②SiH4+2O2=SiO2+2H2O
(4)①蒸馏;②Si+2Cl2 SiCl4,SiCl4+2H2
SiCl4,SiCl4+2H2 Si+4HCl
Si+4HCl
本题解析:
本题难度:一般
5、实验题 下图是苯与溴发生反应并进行产物检验的反应装置,具体实验过程如下
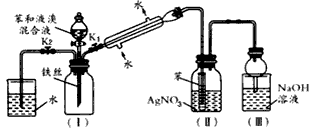
(1)实验开始时,应关闭K2,开启K1,向装置(I)中滴加苯和液溴的混合液,要使分液漏斗中的液体顺利流下,需要进行的操作是________。
(2)反应开始一段时间后,在装置(Ⅱ)中小试管内可能观察到的现象是____________________,小试管中苯的作用是________________________。小试管外可能观察到的现象是____________________。根据
____装置(填装置序号)的现象能证明苯和溴发生的反应是取代反应。
(3)实验装置中的冷凝管“左低右高”放置目的是____________________,整套实验装置中能防止倒吸的装置是____(填装置序号)。
(4)反应结束后,开启K2,关闭K1和分液漏斗活塞,用冷毛巾紧捂装置(I)的广口瓶。此步操作的目的是
____________________
参考答案:(1)打开分液漏斗上的玻璃塞,或将玻璃塞侧面的凹槽对准小孔,再打开分液漏斗活塞
(2)小试管中苯的颜色变成棕红色,有气泡;吸收挥发的溴单质,防止它干扰溴化氢的检验;小试管口有白雾产生,硝酸银溶液中产生淡黄色沉淀;(Ⅱ)
(3)使冷凝回流的反应物苯和液溴回到(I)中继续反应;(Ⅱ)(Ⅲ)
(4)除去装置中的HBr气体,防止污染环境、初步除去(I)中水溶性杂质
本题解析:
本题难度:困难