|
高中化学知识点大全《有关氧化还原反应的计算》高频试题强化练习(2019年最新版)(六)
2019-05-30 05:28:30
【 大 中 小】
|
1、填空题 水是组成生命体的重要物质,有关水的反应实例有很多。
(1)有人设想将太阳能转化为电能,进而将水电解生成氢气,氢气是一种清洁能源。请分析电解水的过程中,水是_____________(填仅被氧化,仅被还原,既被氧化又被还原,既不被氧化又不被还原)
(2)野营爱好者携带氢化钙固体作为生氢剂,方程式为CaH2+2H2O=Ca(OH)2+2H2↑,其中水是_____________(填仅被氧化,仅被还原,既被氧化又被还原,既不被氧化又不被还原)
(3)在下列反应中水只被还原的是_____________(填序号)
A.C+H2O=CO+H2
B.CaO+H2O=Ca(OH)2
C.3Fe+4H2O=Fe3O4+4H2
D.3NO2+H2O=2HNO3+NO
| (4)用双线桥法标出下面反应的电子转移的方向和数目
3NO2+H2O=2HNO3+NO
参考答案:(1)?既被氧化又被还原(2分) (2)?仅被还原?,(2分)
(3)? A、C (2分,少选给1分)
(4)用双线桥法标出下面反应的电子转移的方向和数目?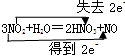
本题解析:(1)H2O所含H元素化合价降低,O元素化合价升高,所以H2O既被氧化又被还原。
(2)H2O只有H元素化合价降低,所以H2O仅被还原。
(3)A、H2O所含H元素化合价降低,被还原;B、H2O所含元素化合价不变,既不被氧化又不被还原;C、H2O所含H元素化合价降低,被还原;D、H2O所含元素化合价不变,既不被氧化又不被还原。
(4)NO2中N元素为+4价,有2个N转化为HNO3,化合价升高为+5价,所以失去2e?,1个N转化为NO,化合价降低为+2价,得到2e?,然后可用双线桥法标出电子转移的方向和数目。
本题难度:一般
2、填空题 (7分)实验证明,以下六种物质是一个氧化还原反应的反应物和生成物:NO、FeSO4、H2O、Fe(NO3)3、HNO3和Fe2(SO4)3。
(1)这六种物质中,反应物是____________;被还原的元素是____________。
(2)若该反应是恰好完全反应,且收集到NO的体积为4.48L(标况时),测得反应后溶液的体积为250mL。
反应过程中转移的电子数为___________;所得溶液中SO42-的物质的量浓度为________mol·L-1。
参考答案:(1)FeSO4、HNO3;N(或氮元素) (2)3.6×1023;2.4
本题解析:(1)氧化还原反应的特征为化合价的升降,反应中HNO3为反应物,具有强氧化性,则NO为生成物,反应中硝酸被还原,为氧化剂,题给物质中元素化合价发生变化的还有Fe,则Fe元素化合价应升高,被氧化,则FeSO4应为还原剂,被氧化生成Fe(NO3)3和Fe2(SO4)3,氮元素的化合价降低,氮元素被还原。
(2)NO的物质的量是4.48L÷22.4L/mol=0.2mol,反应中氮元素的化合价从+5价降低到+2价,得到3个电子,因此反应中转移电子的个数是0.2mol×3×6.02×1023/mol=3.6×1023;铁元素的化合价从+2价升高到+3价,失去1个电子,则根据电子得失守恒可知被氧化的硫酸亚铁的物质的量是0.6mol,所以根据原子守恒可知反应后溶液中硫酸根的浓度是0.6mol÷0.25L=2.4mol/L。
考点:考查氧化还原反应的由于
本题难度:一般
3、填空题 (8分)在下列化学方程式中,指出氧化剂和还原剂,氧化产物和还原产物。
(1)3S+6KOH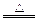 K2SO3+2K2S+3H2O? K2SO3+2K2S+3H2O?
(2)S+2KNO3+3C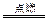 K2S+N2+3CO2 K2S+N2+3CO2
(1)氧 化 剂?还 原 剂?氧化产物?还原产物?
(2)氧 化 剂?还 原 剂?氧化产物?还原产物?
参考答案:(1)S;S;K 2SO3;K2 2SO3;K2 S (2) S (2) S、KNO3;C;CO2;K2S,N2 S、KNO3;C;CO2;K2S,N2
本题解析:略
本题难度:简单
4、选择题 下列反应中盐酸作还原剂的是?(?)
A.CuO +2HCl ="CuCl2" +H2O
B.Fe(OH)3+3HCl =FeCl3 +3H2O
C.Zn+2HCl=ZnCl2 +H2↑
D.2KMnO4 + 16HCl =2KCl+2MnCl2 +5 Cl2↑+ 8H2O
参考答案:D
本题解析:略
本题难度:简单
5、选择题 下列化学用语或模型正确的是
A.氯化氢的电子式: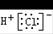
B.8个中子的碳原子:12C
C.硫离子结构示意图: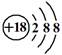
D.CH4分子的比例模型:
参考答案:D
本题解析:共价化合物不要带电子,碳原子为14C。硫离子结构示意图:
本题难度:一般
|