1、选择题 在一定温度和压强下,合成氨反应达到平衡时,下列操作平衡不发生移动的是( )
A.恒温、恒压时充入氨气
B.恒温、恒容时充入氮气
C.恒温、恒容时充入氦气
D.恒温、恒压时充入氦气
2、填空题 研究碳、氮、硫氧化物的性质对化工生产和环境保护有重要意义。
(1)下列措施中,有利于降低大气中的CO2、SO2、NO2浓度的有________(填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟利昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)为开发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料。写出由CO和H2生产甲醇的化学方程式:_____________________,用该反应合成1 mol液态甲醇吸收热量131.9 kJ。又知2H2(g)+CO(g)+ 3/2O2(g)=CO2(g)+2H2O(g) △H=-594.1 kJ/mol。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式:_____________________。
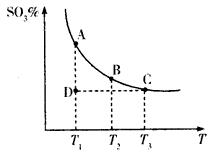
(3)硫酸工业生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)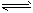 2SO3(g),平衡体系中SO3的百分含量和温度的关系如下图所示。
2SO3(g),平衡体系中SO3的百分含量和温度的关系如下图所示。
根据图示回答下列问题:
①2SO2(g)+O2(g)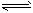 2SO3(g)的△H___0(填“>”或“<”)。
2SO3(g)的△H___0(填“>”或“<”)。
②若温度为T1、T2时,反应的化学平衡常数分别为K1、K2,则K1___K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正_____v逆。
3、填空题 运用化学反应原理可以更好的分析化学反应的本质 。
(1)下列四组物质反应,其中与其它三组有本质不同的是_______。
A.Na2O2 + H2O
B.F2 + H2O
C.Cl2 + H2O
D.NO2 + H2O
(2)在 25℃下,向浓度均为 0.1mol·L-1 的NaCl和KBr混合溶液中逐滴加入硝酸银溶液,先生成_______沉淀 ( 填化学式 );当两种沉淀共存时溶液中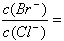 __________。(已知 25℃时 Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10)?
__________。(已知 25℃时 Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10)?
(3) 汽车尾气净化中的一个反应如下:2NO(g)+2CO(g) N2(g)+2CO2(g) 该反应混合体系中NO 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
N2(g)+2CO2(g) 该反应混合体系中NO 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
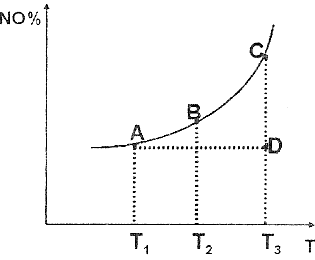
① 2NO(g)+2CO(g)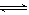 N2(g)+2CO2(g) 的△H _____0( 填 “>” 或 “<”)
N2(g)+2CO2(g) 的△H _____0( 填 “>” 或 “<”)
②若温度为Tl 、T2, 反应的平衡常数分别为 Kl、K2, 则K1_____K2;若反应进行到状态D 时,V正___V逆(填“>”、“<”或“=”)
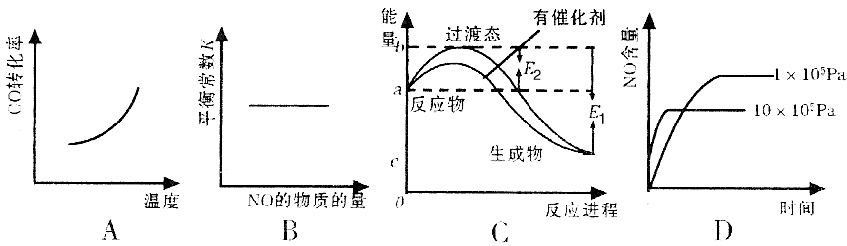
③在恒容的密闭容器中,该反应达平衡后,改变某一条件,下列示意图不正确的是
(4)分析下表提供的数据:
化学式
?电离常数
HClO
Ki=3×10-8
H2CO3
Ki1=4.3×10-7
H2CO3
Ki2=5.6×10-11
① 84 消毒液 ( 有效成分为 NaClO) 久置于空气中会失效,写出发生反应的离子方程式:____________; __________________。
②判断在等浓度的 NaClO、NaHCO3混合溶液中,各种离子浓度由大到小的顺序:_________________。
4、填空题 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为:___________________________。
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)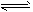 CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)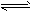 CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) + H2(g);ΔH=-41.3 k J·mol-1
CO2(g) + H2(g);ΔH=-41.3 k J·mol-1
总反应:3H2(g) + 3CO(g)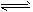 CH3OCH3(g) + CO2(g)的ΔH= ___________;K=?______? (用包含K1、 K2、 K3的式子表示)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
CH3OCH3(g) + CO2(g)的ΔH= ___________;K=?______? (用包含K1、 K2、 K3的式子表示)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)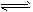 CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下

① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率
v(CH3OH) = __________。
5、填空题 t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:
2SO2(g)+O2(g)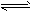 2SO3(g),△H=-196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物
2SO3(g),△H=-196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物
O2还乘余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为_______;平衡时SO2转化率为_________。
?(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)_______________。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是__________。
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为_____________。