1、选择题 A、B、C短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物x和y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的组合是( ?)?
①?B与C均存在同素异形体? ②x的种类比y的多? ③常温下,B氢化物中无H+
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐

A.①②③④? B.②③? C.①②④? D.①④
参考答案:C
本题解析:略
本题难度:简单
2、填空题 (10分)T、X、Y、Z是中学化学常见的四种短周期元素,原子序数依次增大,其结构或性质信息如下表:
元素
| 结构或性质信息
|
T
| 基态原子的L层上s电子数等于p电子数
|
X
| 基态原子最外层未成对电子数在该元素所在周期中最多
|
Y
| 基态原子的第一电离能在该元素所在周期中最小
|
Z
| 单质常温、常压下是气体。基态原子的M层上有1个未成对p电子
|
请根据信息回答有关问题(用具体元素符号或化学式作答)
(1)T、X、Y三种元素的电负性由大到小的顺序是?。
(2)写出元素Z基态原子的电子排布式?。
(3)X的氢化物分子间能形成氢键,Z的氢化物分子间不易形成氢键,试分析原因是?。
(4)分子HTX中,有?个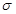 键,?个
键,?个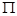 键。
键。
参考答案:(1)N > C > Na,?(2)1S22S22P63S23P5,
(3)N的电负性较大,而原子半径较小,?(4)2,2
本题解析:根据元素的结构及有关性质可知,T、X、Y、Z分别是C、N、Na、Cl。
(1)非金属性越强,电负性越大,因此是N > C > Na。
(2)根据构造原理可知,Cl元素基态原子的电子排布式为1S22S22P63S23P5。
(3)由于N的电负性较大,而原子半径较小,所以氮元素能形成氢键,而氯元素不能。
(4)该物质是HCN,其中H和C之间形成的是单键,C和N之间是三键。三键是由1个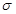 键和2个
键和2个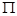 键构成的,所以该分子中含有个
键构成的,所以该分子中含有个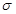 键,2个
键,2个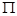 键。
键。
本题难度:一般
3、填空题 (一)短周期A、B、C、D 四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,可生成一种原子个数比为1:1的且不溶于水的固体E;D的L层电子数等于K、M两个电子层上电子数之和。
(1)A元素的名称为?(2)B原子的阴离子的结构示意图为?。
(3)C元素位于元素周期表中第?周期、第?族。
(4) D的质子数和中子数相等,它的最高价氧化物对应的水化物化学式为:??。
(二)根据元素周期表及其元素周期律回答下列问题:
(1)预测52号元素在周期表中的位置:第?周期?族。
(2)已知硒为第四周期第ⅥA族元素,据此推测硒不可能具有的性质是(?)
A.最高正化合价为+6价,? B.气态氢化物比H2S稳定,
C.最高价氧化物的水化物的酸性比硫酸弱,? D.单质在常温下可与氢气化合。
(3)已知X为ⅡA族元素,其原子序数为a,Y与X位于同一周期,且为ⅢA族元素,则Y的原子序数b=?(写出b与a所有可能的关系)。
参考答案:(一) (1)碳?(2)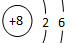 。?(3)三、ⅡA? (4) H2SO4
。?(3)三、ⅡA? (4) H2SO4
(二)(1)五?ⅥA?(2)BD
(3)b= a+1? b=a+11? b=a+25?(写出b与a所有可能的关系)
本题解析:(一)D的L层电子数等于K、M两个电子层上电子数之和,因此D是S元素。A原
子的最外层上有4个电子,说明A是ⅣA元素,又因为A的原子序数是四种元素中序数最小的,所以A只能C元素。根据B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,可生成一种原子个数比为1:1的且不溶于水的固体E,说明E是MgO,即B为O元素,C是Mg元素。
(二)(1)依据周期表的结构可以计算出元素的位置,52-2-8-8-18=16,因此该元素位于第五周期。又因为第五周期有18种元素,所以该元素位于ⅥA族。
(2)依据元素周期律可得出选项BD不可能。
(3)考查元素周期表的结构。第ⅡA族和第ⅢA族元素若是第二、三周期,则相差1;若为第四、五周期则相差11;若是第六、七周期则相差25
本题难度:一般
4、选择题 世界上第一张元素周期表的作者是
A.拉瓦锡
B.凯库勒
C.门捷列夫
D.居里夫人
参考答案:C
本题解析:考查化学史。答案选C。
本题难度:简单
5、选择题 下列说法中正确的是
①晶体中只要有阳离子,就一定有阴离子
②极性分子中肯定含有极性键,则含有极性键的的分子一定是极性分子
③离子化合物一定含有离子键,则共价化合物中一定不含有离子键
④VIIA族单质从上到下,熔沸点越来越高,则IA族单质的熔沸点也越来越高
⑤H2O分子间存在着氢键,故H2O分子比H2S分子稳定
⑥在熔融状态和水溶液中均不能导电的物质称为非电解质
⑦HClO4酸性比H2SO4酸性强,说明氯的非金属性比硫强
A.①②③⑤
B.②④⑥
C.③⑦
D.①③⑥
参考答案:C
本题解析:①金属晶体中只有阳离子和自由电子而无阴离子;②甲烷就是含有四个极性键的非极性分子;④IA族单质均为金属,自上而下,它们的阳离子半径越来越大,金属键越来越弱,熔沸点也越来越低;⑤氢键属于分子间力,只影响物质的物理性质,与分子的稳定性无关;⑥非电解质的前提是化合物。故选C
本题难度:一般