1、填空题 为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A、B、C所示。

(1)在相同条件下,三种气体在水中溶解度最大的是________(写化学式)写出A烧杯中发生反应的化学方程式:____?。如果在三只烧杯中分别滴几滴紫色石蕊试液,可观察到的现象是_____________________?。
实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图D、E、F所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
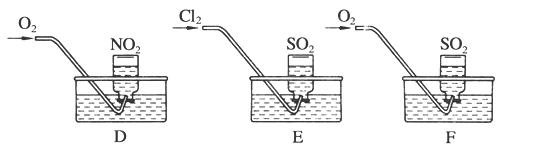
(2)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:
_______________________________________________。
②假设该实验条件下,气体摩尔体积为a L·mol-1。则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________________。
(3) 写出实验F通入氧气后,发生反应的化学方程式:____________________________。
(4)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,可能观察到的现象为________,用有关的离子方程式解释原因:________________________。
参考答案:(1)NO2
3NO2+H2O=2HNO3+NO?溶液都变红色
(2)①4NO2+O2+2H2O=4HNO3?②1/a mol·L-1
(3) 2SO2+O2+2H2O=2H2SO4
(4)出现白色沉淀? Cl2+SO2+2H2O=2Cl-+SO+4H+? Ba2++SO=BaSO4↓
本题解析:(1)NO2在水中的溶解度最大;A试管剩余气体的体积为试管体积的1/3,所以A中气体为NO2,NO2与H2O反应的方程式为:3NO2+H2O=2HNO3+NO;SO2与H2O反应生成H2SO3,NO2与H2O反应生成HNO3,CO2与水反应生成H2CO3,都显酸性,滴入石蕊试液变红。
(2)①由3NO2+H2O=2HNO3+NO和2NO+O2=2NO2,可推出总反应化学方程式为:4NO2+O2+2H2O=4HNO3
②设集气瓶的体积为VL,则充满的NO2也为VL,HNO3的浓度为:VL÷aL/mol÷VL=1/a mol·L-1。
(3)O2氧化SO2,化学方程式为: 2SO2+O2+2H2O=2H2SO4
(4)Cl2在H2O存在的条件下把SO2氧化,生成SO42?,SO42?与Ba2+反应生成BaSO4沉淀,试液现象为:出现白色沉淀;反应的离子方程式为:Cl2+SO2+2H2O=2Cl-+SO+4H+ Ba2++SO=BaSO4↓。
本题难度:一般
2、选择题 下列关于氯水的说法中正确的是( )
A.新制氯水中所含分子只有Cl2和H2O分子,所含的离子只有H+、Cl-、ClO-和OH-
B.新制氯水能杀菌消毒是因为Cl2有毒,能毒杀细菌
C.氯水光照条件下有气泡逸出,该气体是Cl2
D.氯水放置数天后酸性会增强
参考答案:A.新制氯水中所含分子只有Cl2和H2O、HClO分子,所含的离子只有H+、Cl-、ClO-和OH-,故A错误;
B.新制氯水能杀菌消毒,是因HClO具有强氧化性,可杀菌消毒,故B错误;
C.氯水光照条件下有气泡逸出,发生2HClO光照.2HCl+O2↑,故C错误;
D.由选项C可知,HClO分解生成盐酸,酸性增强,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 向NaBr、NaI、Na2CO3的混合溶液中通入足量氯气后,将溶液蒸于并充分灼烧,得到固体剩余物的组成可能是
[? ]
A.NaCl
B.NaCl、NaHCO3
C.NaCl、I2
D.NaCl、NaI、Na2CO3
参考答案:A
本题解析:
本题难度:一般
4、选择题 现有两瓶溶液,新制的饱和氯水和SO2的饱和水溶液,下列方法或试剂(必要时可加热):①观察颜色②石蕊试剂③品红溶液,能用于鉴别它们的是( )
A.①②③
B.只有①③
C.只有②③
D.只有①②
参考答案:①Cl2是新制氯水的主要成分,溶液呈浅黄绿色,而亚硫酸无色,故①正确;
②C12与水反应生成HCl和HClO,HClO能使石蕊试液先变红后褪色,而亚硫酸只能使石蕊试液变红,故②正确;
③HClO的强氧化性将有色物质氧化成无色物质,不可逆,SO2能使品红溶液褪色,加热会恢复原来的颜色,故③正确;
故选A.
本题解析:
本题难度:简单
5、实验题 某学生应用下图所示的装置来研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气
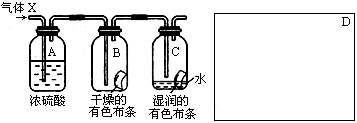
回答下列问题:
(1)该项研究(实验)的主要目的是?。
(2)浓H2SO4的作用是?,与研究目的直接相关的实验现象是?。
(3)该实验装置设计上存在的缺陷为?,请在上图的D处画出能克服该缺陷的装置。
参考答案:(1)比较干燥C12与湿润C12谁有漂白性;
(2)吸收气体X中的水;? B中的布条不褪色,C中的布条褪色;
(3)Cl2会污染空气;如图: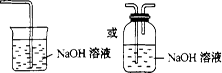 (其他装置合理也可)
(其他装置合理也可)
本题解析:该实验是气体X通过浓硫酸干燥氯气,干燥的氯气通入B,不能使干燥的有色布条褪色。再通入湿润的有色布条,布条褪色,证明干燥氯气不具有漂白性。氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,同时考虑氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收:Cl2+2NaOH=NaCl+NaClO+H2O。
(1)本实验为对比实验,将氯气分别通入干燥布条和湿润布条,根据实验现象的不同来探究氯气具有漂白性的条件。因此该项研究(实验)的主要目的是比较干燥C12与湿润C12谁有漂白性。
(2)浓硫酸具有吸水性,常用作干燥剂,在实验中吸收气体X中的水的作用。与研究目的直接相关的实验现象是B中的布条不褪色,C中的布条褪色。
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收,所以该实验装置设计上存在的缺陷为Cl2会污染空气,改进的方法是加上尾气处理装置。
点评:该题以氯气的性质实验探究为载体,侧重对学生实验能力的考查,涉及气体的净化、除杂、性质检验、尾气处理以及实验分析与评价,有利于培养学生规范、严谨的实验设计能力,有利于提升学生的学科素养。
本题难度:一般