1、填空题 一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:? 3A(g)+B (g) xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白:
xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白:
(1) x=?;?1min内,B的平均反应速率为_________;
(2)若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
(3)平衡混合物中,C的体积分数为22%,若维持容器压强不变,达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
(4)若改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n (B)、n(C)之间应满足的关系式__________________ 。
参考答案:(1)2?0.2 mol/(L·min);?(2) 小于
(3)大于?(4)n(A)+3n(C)/2=3? n(B)+ n(C)/2=1。
本题解析:
3A(g) + B (g)? xC(g)
xC(g)
起始? 3? 1? 0
转化? 1.2? 0.4?0.4×2=0.8
1min? 1.8? 0.6
所以x=2? B的平均反应速率为0.2 mol/(L·min)
(2)1min是C的浓度为0.4mol/L,2min平衡时随反应浓度降低,反应速率减慢,因此C的浓度小于0.8 mol/L。
(3)若维持容器压强不变,需要缩小容器体积,有利于反应正向移动,因此C的体积分数大于22%。
(4)根据等效平衡原理,需要满足:n(A)+3n(C)/2=3? n(B)+ n(C)/2=1。
本题难度:一般
2、选择题 一定条件下在2L密闭容器中加入一定量A,发生反应:A(气)===2B(气),2B(气)===C(气)+2D(气),测得平衡时A为0.3mol/L,B为0.2mol/L,C为0.5mol/L。最初在容器里加入A的物质的量是?(?)
A.0.6 mol
B.1.8 mol
C.1.2 mol
D.1.5 mol
参考答案:B
本题解析:略
本题难度:简单
3、选择题 在密闭容器中的一定量混合气体发生反应:xA(g)+ yB(g) zC(g)平衡时测得A的浓度为
zC(g)平衡时测得A的浓度为
0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.3 mol/L。下列有关判断正确的是
[? ]
A.x+y<z
B.平衡向正反应方向移动
C.B的转化率降低
D.C的体积分数增大
参考答案:C
本题解析:
本题难度:一般
4、填空题 将FeCl3溶液与NH4SCN溶液混合发生如下反应
①Fe3++SCN- Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN-
Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN- Fe(SCN)2+ K2
Fe(SCN)2+ K2
红色 深红色
(1)已知:若起始c(Fe3+)、c(SCN-)均为0.001 mol/L,测得混合溶液中c(Fe3+)约为8.5×10-4 mol/L,c[Fe(SCN)2+]约为1.5×10-4 mol/L,c[Fe(SCN)2+]约为5×10-6 mol/L,则反应②的平衡常数K2为 。
(2)取两份混合溶液,分别向溶液中滴加同体积同浓度的FeCl3溶液与NH4SCN溶液,溶液颜色均加深,其原因是 。仔细观察,滴加NH4SCN溶液时,混合液颜色更深一些,其原因是 。
(3)向FeCl2与NH4SCN混合溶液中滴加酸化的H2O2溶液,溶液先变红,写出H2O2与Fe2+反应的离子方程式 ,继续滴加H2O2,溶液褪色,产生大量能够使澄清石灰水变浑浊的气体且硫氰根中氮元素全部转化为N2,向反应后的溶液中滴加BaCl2溶液,有不溶于稀盐酸白色沉淀生成。写出H2O2与SCN-反应的离子方程式 。
(4)为测定某溶液中c(Cl-),取待测液V1 mL,向其中加入V2 mL浓度为c2 mol/L的AgNO3溶液(过量),再加入少量铁铵矾[NH4Fe(SO4)2·12H2O]作指示剂,用NH4SCN标准溶液(浓度为c3 mol/L)滴定剩余的Ag+,消耗NH4SCN溶液体积为V3 mL。(已知Ag++SCN- = AgSCN↓(白色沉淀),Ksp(AgSCN)=4.9×10-13、Ksp(Ag Cl)=1.56×10-10)。请回答:
①在用NH4SCN标准溶液滴定前,应先通过过滤除去生成的AgCl,若不过滤,则测定结果将 。(填“偏高”,“偏低”或不变)。
②最终测得c(Cl-)= mol/L。
参考答案:(1)39.7
(2)两种物质均促使①②反应向正向移动
Fe3+对反应①影响程度较大,NH4SCN不仅促进反应①正向移动,也直接促进
反应②正向移动,生成了更多的深红色物质
(3)H2O2+2H++2Fe2+= 2Fe3++ 2H2O
2SCN-+11H2O2= 2SO42-+2CO2↑+N2↑+ 10H2O+2H+
(4)偏低 (V2 c2-V3 c3)/ V1
本题解析:(1)反应②的平衡常数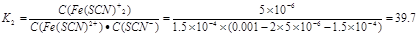
(2) 取两份混合溶液,分别向溶液中滴加同体积同浓度的FeCl3溶液与NH4SCN溶液,由于Fe3+、SCN-的浓度都增大,使①②两个可逆反应都向正向移动,产生更多的有色物质,实验溶液颜色均加深。(3)向FeCl2与NH4SCN混合溶液中滴加酸化的H2O2溶液,溶液先变红,是因为发生反应:H2O2+2H++2Fe2+= 2Fe3++ 2H2O,然后发生上述的①②反应。当继续滴加H2O2,溶液褪色是因为又发生了反应2SCN-+11H2O2= 2SO42-+2CO2↑+N2↑+ 10H2O+2H+ ,由于消耗了SCN-, 使两个可逆反应的化学平衡都向逆反应方向移动,所以溶液的元素变浅甚至褪去。(4)①在用NH4SCN标准溶液滴定前,应先通过过滤除去生成的AgCl,若不过滤除去生成的AgCl,在进行滴定时当溶液中Ag+降低到一定浓度时,AgCl沉淀就会逐渐溶解转化为溶液中,而与滴加的SCN-发生沉淀反应Ag++SCN- = AgSCN↓,这样原待测溶液中Cl-消耗的Ag+就会偏少。所以测定结果将偏低。②n(SCN-)=C·V=C3·V3×10-3mol,根据Ksp(AgSCN)=4.9×10-13可得剩余的Ag+的物质的量n(Ag+)=n(SCN-) =C3·V3×10-3mol,则与Cl-的Ag+的物质的量为:(C2·V2×10-3- C3·V3×10-3)mol因为Ag++Cl-=AgCl↓所以原来的溶液中含有的氯离子的物质的量为(C2·V2×10-3- C3·V3×10-3)mol。因此最终测得c(Cl-)=n(Cl-)/V=(C2·V2×10-3- C3·V3×10-3)mol÷V3×10-3L=(C2·V2- C3·V3)÷V3mol/L.
考点:考查外界条件对化学平衡移动的影响、离子方程式的书写及化学平衡常数、溶液中离子的浓度的计算等知识。
本题难度:困难
5、选择题 已知下列反应的平衡常数:
H2(g)+S(s)?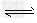 H2S(g) K1
H2S(g) K1
S(s)+O2(g)?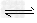 SO2(g) K2
SO2(g) K2
则反应H2+SO2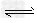 ?O2+H2S的平衡常数为
?O2+H2S的平衡常数为
[? ]
A.K1+K2
B.K1-K2
C.K1×K2?
D.K1/K2
参考答案:D
本题解析:
本题难度:一般