1、选择题 下列说法正确的是(? )
A.同温同压下,H2 + Cl2 = 2HCl在光照和点燃条件的△H不同
B.粗铜精炼时,与电源负极相连的是粗铜
C.船底镶嵌锌块,锌作负极,以防船体被腐蚀
D.天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源
参考答案:C
本题解析:反应的焓变(△H)与物质的量有关,而与反应条件无关,故A错误;
粗铜精炼时,粗铜做电解池的阳极(主反应为:Cu-2e-=Cu2+),应与外加电源的正极相连,故B错误;
船底镶嵌锌块,构成锌-铁原电池,锌比铁活泼,故锌作负极:Zn-2e-=Zn2+,铁作正极受到保护,C正确;
天然气、沼气和水煤气分别属于化石能源、可再生能源和二级能源,故D错误;
本题难度:一般
2、选择题 为研究金属腐蚀的条件和速度,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,再放置于玻璃钟罩里保存相同的一段时间,下列对实验结束时现象的描述不正确的是
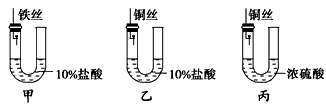
[? ]
A.装置甲左侧的液面一定会下降
B.装置乙中的铁钉腐蚀最快
C.装置丙中的铁钉几乎没被腐蚀
D.装置甲中的铁丝和装置乙中的铜丝都会被腐蚀
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列实验装置图合理的是
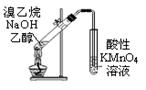 ?
?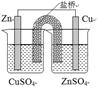 ?
?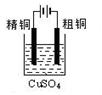 ?
?
①? ②?③?④
A.装置①可用于证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
B.装置②能构成锌铜原电池
C.装置③可用于粗铜的电解精炼
D.装置④可用于在实验室测定中和反应的反应热
参考答案:D
本题解析:A.乙醇能够挥发出来,也能使酸性高锰酸钾褪色,错误;B.装置②电解质溶液放反了,锌离子不能得到电子,错误;C.电解精炼铜中粗铜要做阳极的,错误;D正确。
本题难度:一般
4、选择题 下列说法不正确的是(?)
A.铁表面镀锌,铁作阳极
B.船底镶锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应: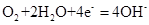
D.工业上电解饱和食盐水的阴极反应: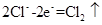
参考答案:A
本题解析:电镀时镀层金属作阳极,待镀金属作阴极,含有镀层金属离子的溶液作电镀液,所以A中铁作阴极,锌作阳极,选项A不正确,其余都是正确的,答案选A。
本题难度:简单
5、选择题 用石墨作电极电解1 L 1 mol·L-1 CuSO4溶液,当c(Cu2+)="0.5" mol·L-1时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状况(?)
A.CuSO4
B.CuO
C.Cu(OH)2
D.CuSO4·5H2O
参考答案:B
本题解析:电解过程中的反应为:阳极:4OH--4e-====2H2O+O2↑,阴极:Cu2++2e-====Cu,总反应为2CuSO4+2H2O 2Cu+2H2SO4+O2↑,由以上反应可知,电解使2 mol CuSO4和2 mol H2O变成了2 mol H2SO4,同时析出Cu,放出O2,溶液中每生成1 mol H2SO4,即减少1 mol CuSO4和1 mol H2O。由此可知,要使溶液恢复至原状况,应加入CuO,CuO+H2SO4====CuSO4+H2O。加入Cu(OH)2,也能与H2SO4反应,生成CuSO4和H2O,但生成的水量较多,溶液不能恢复至原状态。也可从溶液中减少了的物质来考虑,这样更简单,从溶液中析出的物质是Cu和O2,每放出1 mol O2,即析出2 mol Cu,Cu与O的物质的量之比为1∶1,所以加入CuO可以使溶液恢复原状。
2Cu+2H2SO4+O2↑,由以上反应可知,电解使2 mol CuSO4和2 mol H2O变成了2 mol H2SO4,同时析出Cu,放出O2,溶液中每生成1 mol H2SO4,即减少1 mol CuSO4和1 mol H2O。由此可知,要使溶液恢复至原状况,应加入CuO,CuO+H2SO4====CuSO4+H2O。加入Cu(OH)2,也能与H2SO4反应,生成CuSO4和H2O,但生成的水量较多,溶液不能恢复至原状态。也可从溶液中减少了的物质来考虑,这样更简单,从溶液中析出的物质是Cu和O2,每放出1 mol O2,即析出2 mol Cu,Cu与O的物质的量之比为1∶1,所以加入CuO可以使溶液恢复原状。
本题难度:一般