1、选择题 在恒温、恒压下,amol A和b mol B在一个容积可变的容器中发生反应: A(g)+2B(g)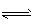 2C(g),一段时间后达到平衡,生成nmol C。则下列说法中正确的是?
2C(g),一段时间后达到平衡,生成nmol C。则下列说法中正确的是?
? [?]
A.物质A、B的转化率之比为1:2
B.起始时刻和达到平衡后容器中的压强之比为(a+b):(a+b-)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
参考答案:C
本题解析:
本题难度:一般
2、填空题 某研究小组为探讨反应 A(g) + 2B(g)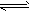 2C(g) + D(s)在催化剂存在的条件下对最适宜反应条件进行了一系列的实验,并根据所得实验数据绘制出下图
2C(g) + D(s)在催化剂存在的条件下对最适宜反应条件进行了一系列的实验,并根据所得实验数据绘制出下图
图中C%为反应气体混合物中C的体积百分含量(所有实验的反应时间相同)。

⑴该反应的反应热为△H______0(填>、<或=)
⑵点M和点N处平衡常数K的大小是:KM________KN(填“>”、“<”或“=”)
⑶工业上进行该反应获得产品C的适宜条件是:温度为_________℃,选择该温度的理由是____________________,压强为_________,选择该压强的理由是________________________
⑷试解释图中350℃前C%变化平缓而后急剧增大、500℃以后又缓慢增加的可能原因:
________________________
参考答案:⑴ >?
⑵ =?
⑶ 500;低于500℃时,C%值太小,高于500℃时C%随温度的升高而增大的幅度不明显,但由于升温带来的燃料及设备成本要求会明显增加;101k Pa;随着压强的增大,C%的增大幅度并不明显,而由于压强增大而带来的动力,设备成本的大幅度增加,故选择常压
⑷ 该反应需要在特定的催化剂作用下才能顺利进行,而该催化剂只有在350℃以上才能体现催化活性并在500℃左右时催化效果最好,500℃以上的变化为温度变化导致平衡移动的情形。
本题解析:
本题难度:一般
3、选择题 在恒温、恒容条件下有下列气体反应:2A(g)+2B(g)?C(g)+2D(g).现分别从两条途径建立平衡:Ⅰ.A和B的起始浓度均为2mol/L;Ⅱ.C和D的起始浓度分别为2mol/L和4mol/L.下列叙述正确的是( )
A.最终达到平衡时,两个体系内混合气体的平均分子量相同
B.最终达到平衡时,Ⅰ中C(A)小于Ⅱ中C(A)的
C.最终达到平衡时,途径Ⅰ的反应时间等于途径Ⅱ的反应时间的
D.最终达到平衡时,途径Ⅰ混合气体的密度为途径Ⅱ混合气体密度的
参考答案:2A(g)+2B(g)?C(g)+2D(g)
Ⅰ2moL/L? 2moL/L
Ⅱ2moL/L 4mol/L
C和D可完全转化为A和B的物质的量浓度分别为4mol/L,相当于在Ⅰ的基础上压缩体积,则
A.在Ⅰ的基础上缩小体积,平衡向正反应方向移动,气体的总物质的量发生变化,混合气体的平均分子量不相同,故A错误;
B.在Ⅰ的基础上缩小体积,如平衡不移动,则Ⅰ中C(A)等于Ⅱ中C(A)的12,但平衡向正方向移动,则,Ⅰ中C(A)大于Ⅱ中C(A)的12,故B错误;
C.由于转化率不确定,则不能确定两种途径达到平衡所用时间的关系,故C错误;
D.途径Ⅱ质量相当于途径Ⅰ的质量的2倍,体积相同,则最终达到平衡时,途径Ⅰ混合气体的密度为途径Ⅱ混合气体密度的12,故D正确.
故选D.
本题解析:
本题难度:一般
4、选择题 对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
[? ]
A.加入一种反应物
B.使用催化剂
C.对平衡体系增加压
D.升高温度
参考答案:D
本题解析:
本题难度:一般
5、选择题 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量)
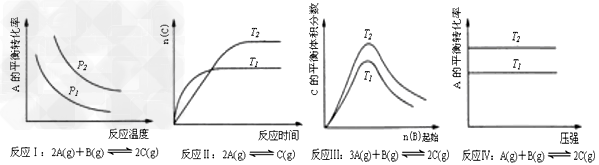
根据以上规律判断,上列结论正确的是
[? ]
A.反应Ⅰ:△H>0,P2>P1?
B.反应Ⅱ:△H<0,T1<T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1?
D.反应Ⅳ:△H<0,T2>T1
参考答案:C
本题解析:
本题难度:一般