1、填空题 (8分)请根据反应:Fe + Cu2+? =? Fe 2++ Cu 设计原电池:
(1)?(2分)画出实验的简易装置图:(用铅笔画图)
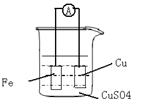
(2)(6分)写出电极反应式,正极:?,负极:?。当反应进行到一段时间后取出电极材料,测得某一电极增重了6.4g,则反应共转移了的电子数是?。
参考答案:(2)? Cu2+ + 2e- = Cu??、?Fe – 2e- = Fe2+?、
0.2mol(或1.204×1023 ) 。
本题解析:活泼金属做Fe(负)Fe – 2e- = Fe2+?Cu(正) Cu2+ + 2e- = Cu?
0.4mol? 0.2mol? NA=0.2NA=1.204×1023
本题难度:一般
2、选择题 某MCFC型燃料电池可同时供应电和水蒸汽,其工作温度为600℃~700℃,所用燃料为氢气,电解质为熔融的K2CO3。该电池的总反应为:2H2+O2=2H2O,负极电极反应式为: H2+CO32——2e— H2O+CO2。则下列判断中正确的是 (? )?
H2O+CO2。则下列判断中正确的是 (? )?
A.放电时CO32—向负极移动
B.放电时CO32—向正极移动
C.正极反应: 4OH——4e—=2H2O+O2↑
D.当电池中生成1 mol水时,转移4 mol电子
参考答案:A
本题解析:根据题意知,该燃料电池燃料为氢气,电解质为熔融的K2CO3,总反应为2H2+O2=2H2O,负极反应为H2+CO32——2e— H2O+CO2,正极反应式:O2+2CO2+4e-
H2O+CO2,正极反应式:O2+2CO2+4e- 2CO32-。A、放电时CO32—向负极移动,正确;B、放电时CO32—应向负极移动,错误;C、正极反应式为:O2+2CO2+4e-
2CO32-。A、放电时CO32—向负极移动,正确;B、放电时CO32—应向负极移动,错误;C、正极反应式为:O2+2CO2+4e- 2CO32-,错误;D、当电池中生成1 mol水时,转移2 mol电子,错误。
2CO32-,错误;D、当电池中生成1 mol水时,转移2 mol电子,错误。
本题难度:一般
3、选择题 下列说法不正确的是
[? ]
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱
参考答案:AC
本题解析:
本题难度:一般
4、选择题 如图有关电化学的图示,完全正确的是( )
A.
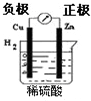
Cu-Zn原电池
B.
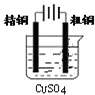
粗铜的精炼
C.
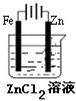
铁片镀锌
D.

验证NaCl溶液(含酚酞)电解产物
参考答案:A、原电池中较活泼的金属作负极,较不活泼的金属或导电的非金属作正极,所以铜-锌-稀硫酸原电池中,锌作负极铜作正极,故A错误;
B、粗铜的精炼中,粗铜作阳极,纯铜作阴极,电解质溶液为含有铜离子的盐,故B错误;
C、电镀时,镀层作阳极,镀件作阴极,所以铁片上镀锌,锌作阳极,铁作阳极,故C错误;
D、电解时,电流流入的电极为阳极,另一电极为阴极,所以电解氯化钠溶液时,根据图片知,碳棒为阳极,铁棒为阴极,阳极上氯离子失电子生成氯气,氯气能置换碘化钾中的碘,碘遇淀粉变蓝色,所以阳极上用淀粉碘化钾溶液可检验氯气的存在;阴极上氢离子得电子生成氢气,利用氢气的燃烧实验检验阴极产物;溶液中有氢氧化钠产生,无色酚酞试液遇碱变红色,所以可用无色酚酞检验氢氧化钠的生成,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 已知反应2A(g)=B(s)+C(g)的ΔH为正值 ,设ΔH和ΔS不随温度而变,下列正确的是
A.该反应熵值增大,故能自发进行
B.高温下能自发进行
C.低温下不能自发变化,高温下能自发变化
D.任何温度下都不能自发变化
参考答案:D
本题解析:ΔG=ΔH-TΔS;ΔG<0 反应以不可逆方式自发进行,ΔG="0" 反应以可逆方式进行,ΔG>0 不能进行。该反应ΔH>0,ΔS<0;故ΔG>0 不能进行。
本题难度:简单