1、简答题 NiSO4-6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤.
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤.
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬.
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀.
⑤______.
⑥______.
⑦蒸发、冷却结晶并从溶液中分离出晶体.
⑧用少量乙醇洗涤并凉干.
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:______.
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是______.
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH在2~4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去.右图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10-39).
下列说法正确的是______(选填序号).
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为6Fe2++Cl
+6H+═6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85℃~95℃生成黄铁矾钢,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是______.
(5)补充上述步骤⑤和⑥(可提供的试剂有6mol/L的H2SO4溶液、蒸馏水、pH试纸).
参考答案:(1)滴入适量的Na2S,生成臭鸡蛋气味气体,应为H2S,反应的离子方程式为S2-+2H+═H2S↑,
故答案为:S2-+2H+═H2S↑;
(2)温度较高时,H2O2分解,加6%的H2O2时,温度不能过高,故答案为:减少过氧化氢的分解;
(3)a.FeOOH中铁为+3价,故a错误;
b.pH=4,C(OH-)=1×10-10mol/L,已知25℃时,Fe(OH)3的Ksp=2.64×10-39,则c(Fe3+)=2.64×10-9,故b错误;
c.ClO3-在酸性条件下具有强氧化性,与Fe2+发生氧化还原反应,
反应的离子方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,故c正确;
d.由图象可知,生成黄铁矾钢所需要的合适温度为85℃~95℃,pH约为1.2~1.8,故d正确,故答案为:cd;
(4)Ni2+水溶液有颜色,可通过判断上清液是否无色判断是否洗涤干净,故答案为:上层清液呈无色;
(5)④得到NiCO3沉淀之后应,应先过滤、洗涤,然后与硫酸反应生成NiSO4,所以操作步骤为:
⑤过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
⑥向沉淀中加6?mol/L的H2SO4溶液,直至恰好完全溶解.
故答案为:⑤过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
⑥向沉淀中加6?mol/L的H2SO4溶液,直至恰好完全溶解.
本题解析:
本题难度:一般
2、填空题 FeS饱和溶液中存在溶解平衡:FeS(s) Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
⑴理论上FeS的溶解度为?。
⑵又知FeS饱和溶液中[H+]与[ S2-]之间存在着如下关系:[H+]2·[ S2-]=1.0×10-22 mol3/L3,为了使溶液里[Fe2+]达到了1mol/L,现将FeS适量投入到其饱和溶液中,应调节溶液中的[H+]为?。
参考答案:⑴7.92×10-8 g;⑵1.11×10-3mol/L。
本题解析:⑴由FeS(s) Fe2+(aq)+S2-(aq),[Fe2+]=
Fe2+(aq)+S2-(aq),[Fe2+]=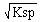 =
=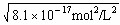 =9×
=9×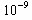 mol/L,即水中溶解的FeS的溶解度为S(FeS)=9×
mol/L,即水中溶解的FeS的溶解度为S(FeS)=9×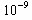 mol/L×88g/mol×
mol/L×88g/mol×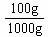 =7.92×10-8 g;⑵由[Fe2+]=1mol/L,则[ S2-]=
=7.92×10-8 g;⑵由[Fe2+]=1mol/L,则[ S2-]=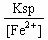 =
=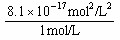 =8.1×10-17 mol/L,又由于[H+]2·[ S2-]=1.0×10-22 mol3/L3,所以[H+]=1.11×10-3mol/L。
=8.1×10-17 mol/L,又由于[H+]2·[ S2-]=1.0×10-22 mol3/L3,所以[H+]=1.11×10-3mol/L。
本题难度:一般
3、选择题 在一定温度下,氯化银饱和溶液中C(Ag+)·C(Cl-) = Ksp。现将足量AgCl固体分别加入下列物质中,各种溶液中AgCl的溶解度最大的是
A.20ml 0.1mol/LHCl溶液? B.30ml 0.2mol/LHCl溶液
C.40ml蒸馏水? D.50ml 0.05mol/LNaCl溶液
参考答案:C
本题解析:由浓度积可知,溶液中的c(Cl-)越大,AgCl的溶解度越小,而各选项中的c(Cl-)依次为:0.1mol/L、0.2mol/L、0、0.05mol/L,故选项C符合题意
本题难度:一般
4、选择题 已知Ag2SO4的KSP=c2(Ag+)× c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,此时溶液中c(Ag+)=0.030 mol·L-1。若t1时刻改变条件,下图中不正确的是
参考答案:D
本题解析:根据沉淀溶解平衡常数,Ag2SO4的KSP=c2(Ag+)× c(SO42-)=1.4×10-5;化学平衡常数是一个温度常数,温度不变,化学平衡常数不变;
A.加入蒸馏水,原饱和溶液,变成不饱和溶液,银离子、硫酸根离子浓度均下降,符合题意;B.加入低浓度的硫酸银溶液,原饱和溶液同样要变成不饱和溶液,各离子浓度均下降,题意符合;
C.加入更大溶度的硫酸钠溶液,硫酸根浓度加大,银离子浓度减小;符合题意;
D.加入更大浓度的硝酸银溶液,银离子浓度加大,根据沉淀溶解平衡常数,硫酸根浓度必然减小,图像不符合题意;
点评:考查沉淀溶解平衡常数,认真审题,读懂图像的意思。
本题难度:简单
5、选择题 已知25 ℃ 时,BaCO3的溶度积Ksp=2.58×10-9,BaSO4的溶度积Ksp=1.07×10-10,则下列说法不正确的是
A.温度一定时,当溶液中c(Ba2+)×c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和
溶液
B.因为Ksp(BaCO3)>Ksp(BaSO4),所以无法将BaSO4转化为BaCO3
C.25 ℃ 时,在未溶解完BaCO3的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析
出,此时溶液中c(CO32-)∶c(SO42-)=24.11
D.在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变
参考答案:B
本题解析:根据溶度积常数的概念可知A正确。能否生成碳酸钡沉淀,关键是溶液中c(Ba2+)×c(CO32-)>2.58×10-9,与溶度积常数大小并没有直接的关系,B不正确。BaCO3的溶度积Ksp=c(Ba2+)×c(CO32-),BaSO4的溶度积Ksp=c(Ba2+)×c(SO42-),因为是在相同的溶液中,所以二者多的溶度积常数的比值就是c(CO32-)∶c(SO42-)=2.58×10-9/1.07×10-10=24.11,C正确。根据平衡移动原理可知,增大c(CO32-),可使平衡向结晶的方向移动,所以c(Ba2+)减小。溶度积常数只和温度有关,所以是不变的,D正确。答案选B。
本题难度:一般