1、选择题 Co2+与SCN-离子生成蓝色Co(SCN)2-离子,可利用该反应检出CO2+;若溶液也含Fe3+,为避免[Fe(NCS)n]3-n离子的红色干扰,可在溶液中加入NaF,将Fe3+掩蔽起来。这是由于生成了
[? ]
A.难溶的FeF3
B.难电离的FeF3
C.难电离的[FeF6]3-
D.难溶的Fe(SCN)F2
参考答案:C
本题解析:
本题难度:一般
2、填空题 [三选一选修3:物质结构与性质]?
血红素中含有C、H、O、N、Fe五种元素。回答下列问题: ?
(1)C、N、O、H四种元素中电负性最大的是__________(填元素符号),Fe2+稳定性比Fe3+稳定性__________(填“强”或“弱”),原因是________?。 ?
(2)下图所示为血红蛋白和肌红蛋白的活性部分——血红素的结构。血红素中N原子的杂化方式有_________,在下图的方框内用“→”标出Fe2+的配位键。?
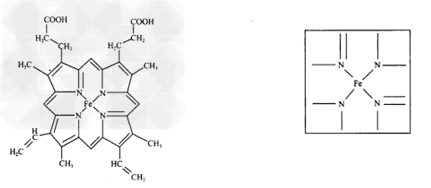
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69?pm和78?pm,则熔点NiO____FeO(填“<”“>”); ?
(4)根据等电子原理,写出N2O的电子式_________,分子的空间构型为__________。
(5)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为__________,δ、α两种晶胞中铁原子的配位数之比为____。
参考答案:(1)O?;弱?;?Fe2+价电子3d6,为不稳定结构,Fe3+价电子3d5,为半充满稳定结构,所以Fe2+稳定性弱于Fe3+
(2)sp2,sp3 ;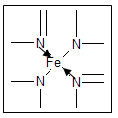
(3)>?
(4)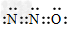 ?;?直线形
?;?直线形
(5)4?;4:3
本题解析:
本题难度:一般
3、填空题 I、
(1)下列描述中正确的是 ________
A、CS2为V形的极性分子
B、ClO3- 的空间构型为平面三角形
C、SF6中有6对完全相同的成键电子对
D、SiF4和SO32-? 的中心原子均为sp3杂化
II、
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
请回答下列问题:
(2)Ni原子的核外电子排布式为___________ ;
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO____ FeO(填“<”或“>”);
(4)NiO晶胞中Ni和O的配位数分别为________ 、____;
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下图所示。该合金的化学式为____;

(6)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是d键,碳氮之间的共价键类型是__________ ,氮镍之间形成的化学键是____;
②该结构中,氧氢之间除共价键外还可存在____; ③该结构中,碳原子的杂化轨道类型有________ 。
参考答案:I 、
(1)C、D
II、
(2)1s22s22p83s23p63d84s2{或[Ar]3d84s2}
3)>
(4)6;6
(5)LaNi5
(6)①σ键、π键;配位键
②氢键
③sp2、sp3
本题解析:
本题难度:困难
4、填空题 硫酸铜晶体溶解后溶液呈天蓝色,再滴加氨水,首先生成沉淀,继续滴加氨水,沉淀溶解,得到深蓝色透明溶液,再加入无水乙醇,析出深蓝色晶体。请根据上述实验现象回答下列问题:
(1)写出配合物CuSO4·4NH3·H2O中的配位中心离子:_______,配体:_______,配位数是:_______。(用化学式或数字表示)
(2)无水乙醇的作用是:____________________
(3)已知蓝色沉淀转化为深蓝色溶液的过程存在下列平衡:Cu(OH)2+4NH3·H2O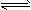 [Cu(NH3)4]2++2OH-+
[Cu(NH3)4]2++2OH-+
4H2O;若对深蓝色溶液进行加热,产生的现象是:_______________。
(4)已知CuSO4·5H2O晶体的结构如图所示;深蓝色晶体的化学式为:CuSO4·4NH3·H2O。其结构与
CuSO4·5H2O晶体的结构相似,请画出CuSO4·4NH3·H2O结构示意图

(5)在CuSO4·4NH3·H2O晶体中,中心原子是sp3杂化的原子有:_______(写元素符号)。 其晶体结构中存在的化学键有:___________。
A.离子键 B.共价键 C.配位键 D.氢键 E.范德华力
参考答案:(1)Cu2+;NH3;4
(2)降低配合物在水中的溶解度使之析出
(3)有刺激性气味的气体产生,产生蓝色沉淀,最终生成黑色沉淀 (4)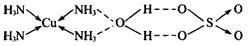 (5)N、O、S;ABC
(5)N、O、S;ABC
本题解析:
本题难度:一般
5、选择题 向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,下列关于实验现象的叙述中不正确的是
[? ]
A.先生成白色沉淀,加入足量氨水后沉淀消失
B.生成的沉淀为AgCl,它不溶于水,但溶于氨水,重新电离成Ag+和Cl-
C.生成的沉淀是AgCl,加入氨水后生成了可溶性的配合物[Ag(NH3)2]Cl
D.若向AgNO3溶液中直接滴加氨水,产生的现象也是先出现白色沉淀后又消失
参考答案:B
本题解析:
本题难度:一般