| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学平衡》练习题(五)
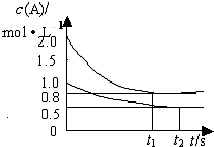 4、填空题 在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)
 (2)右图中表示NO2浓度的变化的曲线是 。 (2)右图中表示NO2浓度的变化的曲线是 。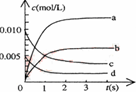 (3)能说明该反应已达到平衡状态的是 。 A.v(NO2)=2v(O2) B.容器内压强保持不变 C.v逆 (NO)=2v正 (O2) D.容器内密度保持不变 (4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。 A.及时分离除NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂 5、填空题 (15分)甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景。工业上可用如下方法合成甲醇:
 2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1 2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1② 2CO(g) + O2(g)  2CO2(g) △H=-566.0 kJ?mol-1 2CO2(g) △H=-566.0 kJ?mol-1③ H2O(l) = H2O(g) △H =" +" 44.0 kJ?mol-1 则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为 。 (2)方法一生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%。请回答下列问题: ①前5分钟内甲醇的平均反应速率为 ;已知该反应在低温下能自发进行,则反应的 △H为 (填“>”、“<”或 “=”)0。 ②在该温度下反应的平衡常数K= 。 ③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,将使ν正 ν逆(填“>”“=”“<”)。 (3)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。 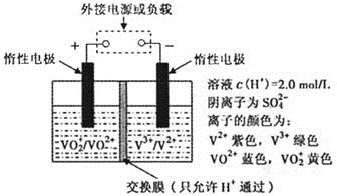 ①当左槽溶液逐渐由黄变蓝,其电极反应式为 。 ②充电过程中,右槽溶液颜色变化是 。 ③若用甲醇燃料电池作为电源对其充电时,若消耗甲醇4.8g时,电路中转移的电量的为 (法拉第常数F=9.65×l04C · mol-1)。 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《大气污染与.. | |