1、选择题 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是(?)
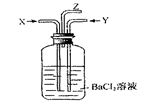
A.洗气瓶中产生的沉淀是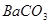
B.在Z导管出来的气体中无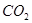
C.洗气瓶中产生的沉淀是
D.在Z导管口有红棕色气体出现
参考答案:D
本题解析:根据题意知,碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,同时通入盛有足量氯化钡溶液的洗气瓶中,NO2、SO2和水反应生成硫酸和NO,NO在空气中又会生成NO2。A、CO2不与氯化钡反应,从导管中逸出,洗气瓶中不会产生碳酸钡沉淀,错误; B、CO2不与氯化钡反应,从导管Z中逸出,错误;C、SO2+H2O+NO2=H2SO4+NO,H2SO4能与氯化钡反应生成BaSO4,所以没有BaSO3生成,错误;D、反应生成的NO在Z导管口与空气中的氧气反应生成NO2,呈红棕色,正确。
本题难度:一般
2、实验题 (10分)化学小组同学依据化学反应Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。
ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。

请回答下列问题:
(1)装置A中添加液体的仪器名称为?;98%的浓H2SO4(ρ=1.84 g/cm3)的物质的量浓度是?;
(2)请写出产生氢气的反应的离子方程式?;
(3)①装置B是为了吸收SO2,则不能选用下列试剂中的?(填序号);
A.NaOH溶液? B.浓H2SO4? C.KMnO4溶液?
②可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有氢气的实验现象是?;
参考答案:(1)分液漏斗? 18.4 mol/L?(2)Zn+2H+===Zn2++H2↑?
(3)① B ②装置E中黑色粉末变红色,F中无水硫酸铜变蓝色?(每空2分)
本题解析:⑴该仪器名称是分液漏斗,C(H2SO4)=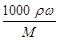 =
=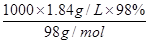 =18.4?mol/L;?
=18.4?mol/L;?
⑵锌和稀硫酸反应生成硫酸锌和氢气,其离子方程式为Zn+2H+═Zn2++H2↑;
⑶①二氧化硫属于酸性氧化物,能被碱液吸收;具有还原性,能被强氧化性溶液吸收,氢氧化钠溶液呈碱性,高锰酸钾溶液具有强氧化性,即可以用氢氧化钠溶液和高锰酸钾溶液吸收二氧化硫,故选B; ?
②氢气具有还原性,能将黑色的CuO还原为红色的Cu,且生成水,水能使无水硫酸铜变蓝色,如果有氢气,看到的现象是:装置E中黑色粉末变红色,F中无水硫酸铜变蓝色。
本题难度:一般
3、实验题 (18分)
张明同学对硫酸及其盐的某些性质中进行了如下实验探究。
[实验一 ]探究浓硫酸的氧化性
]探究浓硫酸的氧化性
 将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
 (1)该装置设计上存在明显缺陷,其缺陷是?__________
(1)该装置设计上存在明显缺陷,其缺陷是?__________ _______________________?___。
_______________________?___。
 (2)装置甲中反应的化学方程式是___________?___。
(2)装置甲中反应的化学方程式是___________?___。
 (3)装置乙中的试剂是_____________________________________________________。
(3)装置乙中的试剂是_____________________________________________________。
[实验二 ]探究某硫酸亚铁盐固体是否变质
]探究某硫酸亚铁盐固体是否变质
 (4)请你帮助张明同学完成如下实验方案:
(4)请你帮助张明同学完成如下实验方案:
实验操作
| 预期现象和结论
|
 ? ?
| ?
|
[实验三]用KHSO4制取H2O2并测其质量分数
 查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
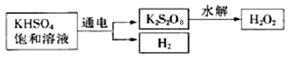

 张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
 ①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
 ②用0.1000 mol/L KMnO4溶液滴定;
②用0.1000 mol/L KMnO4溶液滴定;
 ③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
 请回答:
请回答:
 (5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
(5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
 (6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________?___。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________?___。
 (7)原H2O2溶液中溶质的质量分数是__________?_____?____。
(7)原H2O2溶液中溶质的质量分数是__________?_____?____。
参考答案:共18分
 (1)装置乙不应有瓶塞? (2分)
(1)装置乙不应有瓶塞? (2分)
 (2)Cu+2H2SO4(浓)
(2)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O? (2分)
CuSO4+SO2↑+2H2O? (2分)
 (或C+2H2SO4(浓)
(或C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,其他合理答案也给分)
CO2↑+2SO2↑+2H2O,其他合理答案也给分)
 (3)氢氧化钠溶液(或氢氧化钾溶液等)? (2分)
(3)氢氧化钠溶液(或氢氧化钾溶液等)? (2分)
 (4)往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液;? (2分)
(4)往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液;? (2分)
若溶液变为红色,说明该固体已变质;若溶液未变红色,说明该固体没有变质? (2分)
 (5)2HSO4――2e-=S2O82-+2H+(或2SO42―-2e-=S2O82-)? (3分)
(5)2HSO4――2e-=S2O82-+2H+(或2SO42―-2e-=S2O82-)? (3分)
 (6)催化剂(或加快反应速率)? (2分)
(6)催化剂(或加快反应速率)? (2分)
(7)3.4%? (3分)
本题解析:略
本题难度:一般
4、选择题 2 g某金属加入100 ml 2 mol·L-1的硫酸溶液中,当溶液浓度降到原浓度的一半时(设溶液体积不变),金属还没反应完,该金属可能是?(?)
A.Al
B.Zn
C.Fe
D.Mg
参考答案:A
本题解析:略
本题难度:一般
5、实验题 (10分)
(1)浓硫酸和木炭(C)加热时反应的化学方程式为:
?;
为了验证反应的全部生成物,用下图装置进行实验。

(2)上图A处是完成实验的必要装置,它是下列图中的(填编号)?;

(3) C装置中盛放的试剂为?,
其作用是?;
(4)能够证明存在CO2气体的实验现象是:
?。
参考答案:(1)C + 2H2SO4(浓)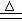 CO2↑ + 2SO2↑ + 2H2O;(2分)
CO2↑ + 2SO2↑ + 2H2O;(2分)
(2)③(2分)
(3)酸性KMnO4溶液(2分)?除去SO2;(2分)
(4)C中酸性KMnO4溶液不褪色,同时D中澄清石灰水变混浊。(2分)
本题解析:由反应C + 2H2SO4(浓) CO2↑ + 2SO2↑ + 2H2O知道,由于CO2和SO2的检验过程中都需要水溶液,故产物检验时必须先检验水,一般用无水硫酸铜;
CO2↑ + 2SO2↑ + 2H2O知道,由于CO2和SO2的检验过程中都需要水溶液,故产物检验时必须先检验水,一般用无水硫酸铜;
而CO2和SO2均为酸性氧化物,性质相近,而SO2具有还原性、漂白性,是独有性质,故可用品红溶液来检验它的存在,再用酸性KMnO4溶液进行吸收,随后用澄清石灰水检验CO2的存在。
本题难度:一般