1、选择题 用NA表示阿伏加德罗常数值,下列叙述正确的是
[? ]
A.17g氨气所含电子数目为10NA
B.标准状态下,1LSO3含有的分子数为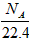
C.2.4g金属镁与足量的盐酸反应,转移电子数为2NA
D.在2L 1mol/L K2CO3溶液中,含有K+和CO32-的总数为6NA
参考答案:A
本题解析:
本题难度:简单
2、选择题 设NA为阿伏加德罗常数值,下列说法中正确的是( )
A.常温常压下,16g氧气和臭氧(O3)的混合气体中含有NA个氧原子
B.将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个
C.12gNaHSO4在熔融时离子总数为0.3NA个
D.标准状况下,11.2L氦气所含的原子数为NA个
参考答案:A、氧气和臭氧是同素异形体,质量相同的氧气和臭氧含有的原子个数相等,所以把混合气体当做氧气或臭氧都行原子个数不变,16g氧气和臭氧(O3)的混合气体中氧原子的物质的量是1mol,所以含有NA个氧原子,故A正确;
B、氯化铁是强酸弱碱盐,部分能发生水解生成氢氧化铁胶体,水解程度未知,所以无法计算胶粒个数,故B错误;
C、熔融态硫酸氢钠电离时生成钠离子和硫酸氢根离子,12gNaHSO4的物质的量是0.1mol,所以12gNaHSO4在熔融时离子总数为0.2NA个,故C错误;
D、标况下,11.2L氦气的物质的量是0.5mol,且氦气分子是单原子分子,所以11.2L氦气所含的原子数为0.5NA个,故D错误.
故选A.
本题解析:
本题难度:简单
3、选择题 NA为阿伏加德罗常数,下列叙述正确的是[M(Fe)=56]( )
A.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA
B.22.4LCH4和CH3Cl的混合物所含有的分子数目为NA
C.5.6?g铁粉在0.1mol氯气中充分燃烧,失去的电子数为0.3NA
D.1mol过氧化氢分子中共用电子对数为3NA
参考答案:解;A、pH=1的醋酸溶液中,氢离子浓度为0.1mol/L,醋酸的浓度一定大于0.1mol/L,但体积未知,无法确定醋酸的分子质的量,故A错误;
B、条件未知,气体的物质的量无法计算,故B错误;
C、5.6?g铁粉物质的量为0.1mol,与0.1molCl2反应,根据反应2Fe+3Cl2=2FeCl3,铁过量,所以电子转移物质的量为0.2
mol,铁失去电子物质的量为0.2mol,故C错误;
D、1mol过氧化氢分子中含有2mol氧氢键,1mol氧氧键,所以含有共用电子对为3mol,故D正确;
故选D.
本题解析:
本题难度:一般
4、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4L苯的分子数约为NA个
B.常温下,在18g18O2中含有NA个氧原子
C.标准状况下,17gNH3所含共价键数为NA个
D.1molNa2O2中含有的阴离子数目为2NA个
参考答案:A.苯在标况下是液体,22.4L苯不是1mol,故A错误;
B.18g18O2 是0.5mol,有1mol氧原子,故B正确;
C.,17g氨是1mol,含有3mol共价键,故C错误;
D.1mol过氧化钠中有1mol阴离子O22-,故D错误.
故选B.
本题解析:
本题难度:一般
5、选择题 设阿伏加德罗常数为NA,则下列说法正确的是( )
A.5.6g铁在足量氯气中燃烧,电子转移0.2NA个
B.1.12L氯气中含有0.1NA个氯原子
C.标准状况下,22.4L的溴单质含NA个溴分子
D.常温常压下,1L0.1mol/LMgCl2溶液中含Cl-离子数为0.2NA
参考答案:A、5.6g铁的物质的量为0.1mol,在足量的氯气中燃烧生成0.1mol氯化铁,失去0.3mol电子,电子转移0.3NA个,故A错误;
B、不是标准状况下,不能使用标况下的气体摩尔体积计算1.12L氯气的物质的量,故B错误;
C、在标准状况下,溴单质为液体,不能使用22.4L/mol计算出溴的物质的量,故C错误;
D、1L 0.1mol/L MgCl2溶液中含有溶质氯化镁0.1mol,含有0.2mol氯离子,含Cl-离子数为0.2NA,故D正确;
故选D.
本题解析:
本题难度:简单