1、选择题 在配置Fe2(SO4)3溶液时,为了防止水解,常常往溶液中加入少量的:
A.NaOH
B.H2SO4
C.KCl
D.CH3COOH
参考答案:B
本题解析:Fe2(SO4)3溶液水解呈酸性:Fe3++3H2O Fe(OH)3+3H+,故经常加入相应的酸来抑制水解,答案为B
Fe(OH)3+3H+,故经常加入相应的酸来抑制水解,答案为B
本题难度:简单
2、选择题 下列叙述错误的是 ( )
A.把a L 0.1 mol/L 的CH3COOH溶液与b L 0.1 mol/L的 KOH溶液混合,所得溶
液中一定存在:c (K+)+ c (H+) =" c" (CH3COO-) + c (OH-)
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.把0.1 mol/L 的NaHCO3溶液与0.3 mol/L 的Ba(OH)2溶液等体积混合,所得溶
液中一定存在:c (OH-) >c (Ba2+)>c (Na+)> c (H+)
D.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
参考答案:B
本题解析:A、电荷守恒,正确;B、c(ClO-) >c(OH-),OH-是水电离产生,很小,错误;C、HCO3-+OH-= CO32-+ H2O,Ba2++ CO32-=" Ba" CO3↓, c(OH-)="0.5" ,c (Ba2+)="0.2," c (Na+)="0.1," c (H+)由水电离产生的,很小,所以c (OH-) >c (Ba2+)>c (Na+)> c (H+),正确;D、CH3COOH溶液c (H+)等于pH=11的NaOH溶液的c(OH-),为10-3,Kw =10-14?,另外的H+?和OH- 相等,是水电离产生的,正确。
本题难度:一般
3、选择题 0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是(? )
A.c(K+)+c(H+)=c(S2—)+c(HS—)+c(OH—)
B.c(K+)+ c(S2—) = 0.3mol/L
C.c(K+)=c(S2—)+c(HS—)+c(H2S)
D.c(OH-)=c(H+)+c(HS—)+2c(H2S)
参考答案:D
本题解析:A不正确,不符合电荷守恒,应该是c(K+)+c(H+)=2c(S2—)+c(HS—)+c(OH—);B和C都不正确,不符合物料守恒,分别应该是c(K+)+ c(S2—)+c(HS—)+c(H2S) = 0.3mol/L、c(K+)=2c(S2—)+2c(HS—)+2c(H2S);D正确,符合质子守恒,答案选D。
点评:判断溶液中离子浓度关系的关键是掌握几个守恒关系式,即电荷守恒、物料守恒和质子守恒。
本题难度:一般
4、选择题 25°C时,在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的是:
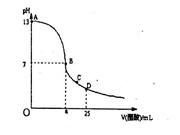
A.在A、B间任一点,溶液中一定都有c(Na+)﹥c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c,( CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+ )
参考答案:B
本题解析:略
本题难度:简单
5、选择题 在蒸发皿中加热蒸干并灼烧,下列物质的溶液,可以得到该固体物质的是
A.氯化铝
B.碳酸氢钠
C.高锰酸钾
D.硫酸铁
参考答案:D
本题解析:A错,热蒸干氯化铝溶液,铝离子会水解生成氢氧化铝,灼烧生成氧化铝;
B错,碳酸氢钠不稳定受热易分解为碳酸钠,加热后得到的固体为碳酸钠;
C错,高锰酸钾受热不稳定易分解为锰酸钾、二氧化锰。
D正确,硫酸铁溶液中虽然+3铁离子要发生水解,但水解后生成的氢氧化铁与硫酸会继续反应,最终得到硫酸铁固体。
本题难度:一般