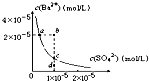1、选择题 若室温下0.1mol/L NaX溶液中pH=9,则该溶液中发生水解反应的X-占全部X-的( ? )
A.无法确定
B.0.09%
C.1.0%
D.0.01%
参考答案:D
本题解析:
本题难度:一般
2、填空题 已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液
(2)各取5mL上述溶液,分别加热(温度相同),pH较小的是________溶液
(3)H2SO4溶液和NH4Cl溶液中由水电离出的c(H+)之比为__________
(4)取5mL NH4Cl溶液,加水稀释至50mL,c(H+) ____________ 10-6mol·L-1(填“>”、“<”或“=”),
c(NH4+)/c(H+)_______________(填“增大”、“减小”或“不变”)
参考答案:(1) H2SO4
(2) NH4Cl
(3) 10-4:1
(4) > 减小
本题解析:(1)氯化铵溶液的pH=5是因为铵根离子的水解造成的,而加水稀释会促进氯化铵水解正向进行,抑制氢离子浓度的减小,所以pH增大较多是硫酸溶液,则pH较大的是H2SO4;
(2)加热促进氯化铵的水解,溶液中氢离子浓度增大,pH减小,而硫酸中的氢离子浓度不变,所以pH不变,所以pH较小的溶液是NH4Cl溶液;
(3)酸对水的电离起抑制作用,而盐的水解对水的电离起促进作用,硫酸溶液中水电离产生的氢离子浓度等于溶液中的氢氧根离子浓度为1×10-9mol/L,而氯化铵溶液中的水电离产生的氢离子浓度即是溶液中的氢离子浓度为1×10-5mol/L,所以二者由水电离出的c(H+)之比为1×10-9mol/L/1×10-5mol/L=10-4:1
(4)氯化铵稀释时,水解平衡正向移动,所以稀释10倍后溶液的pH增加值小于1,pH<6,则c(H+)>10-6mol·L-1; c(NH4+)/c(H+)=c(NH3?H2O)/K,加水稀释,c(NH3?H2O)减小,所以比值减小。
考点:考查溶液稀释后pH的变化,离子浓度的变化关系的判断
本题难度:一般
3、选择题 一定条件下,下列药物的主要成分都能发生:取代反应、加成反应、水解反应和中和反应的是( )
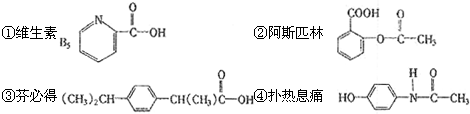
A.①④
B.②④
C.①③
D.③④
参考答案:B
本题解析:
本题难度:简单
4、选择题 一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是
A.次磷酸的电离方程式为H3PO2 3H++PO23-
3H++PO23-
B.次磷酸中P的化合价为+1
C.NaH2PO2是酸式盐
D.NaH2PO2溶液显弱酸性
 MgCl2+6H2O
MgCl2+6H2O