1、填空题 。A、B、C、 D、 E五种溶液分别是NaOH、 NH3·H2O、 CH3COOH 、HCl 、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1?xL B溶液、0.001mol·L-1?yL D溶液充分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是?溶液,判断理由是?。
(2) 用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是??(填写序号)
①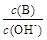 ;?②?
;?②?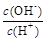 ;
;
③c(H+)和c(OH-)的乘积?④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A?②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E?④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余?⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如右图中的_________曲线(填写序号) 。
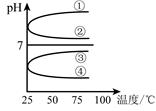
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
参考答案:(1)NaOH?中和酸性物质A只有NaOH、NH3·H2O,物质的量的A与等物质的量浓度B和D混合呈中性,D的用量少,说明D碱性比B的碱性强,所以D是NaOH。
(2)①②?(3)③④⑤ (4)④? (5) c(Na+)> c(SO42-)>c(NH4+)>c(OH-)=c(H+)
本题解析:考查电解质溶液之间的反应,涉及到强电解质、弱电解质的电离、盐类的水解及溶液的pH值、离子浓度大小的比较等知识。
(1)能中和酸性物质A的只有NaOH、NH3·H2O,等物质的量的A与等物质的量浓度B和D混合呈中性,D的用量少,说明D碱性比B的碱性强,所以D是NaOH。所以再根据其它信息可知,A是盐酸,B是氨水,C是NH4HSO4,D是氢氧化钠,E是CH3COOH。
(2)氨水是弱电解质,存在电离平衡,稀释促进电离,OH-的物质的量增加,但浓度降低。温度不变,水的离子积常数不变。所以答案选①②。
(3)OH-浓度相同,则氢离子浓度也是相同的,因此起始时反应速率相同;由于醋酸是弱酸,所以醋酸的浓度大于盐酸的,因此醋酸中锌是不足的,盐酸中酸是不足的。在反应过程中,醋酸会继续电离出氢离子,所以醋酸的反应速率大,所用时间少,答案选③④⑤
(4)等体积、等物质的量浓度B和C混合后,恰好生成硫酸铵。硫酸铵水解,溶液显酸性。加热促进水解,所以pH降低,答案选④。
(5)溶液显中性时,溶质是硫酸钠、硫酸铵以及氨水。所以根据电荷守恒可知,离子浓度大小顺序是c(Na+)> c(SO42-)>c(NH4+)>c(OH-)=c(H+)。
本题难度:一般
2、选择题 下列说法正确的是
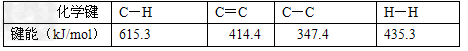
[? ]
A. 已知(如上图),则可以计算CH3-CH3→CH2=CH2+H2;ΔH?=+125.6?kJ/mol?
B.?已知:25℃时,CaCO3的Ksp为2.9×10-9,CaF2的Ksp为2.7×10-11在CaCO3悬浊液中加入? NaF固体,CaCO3不可能全转化为CaF2
C. 常温下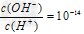 的溶液中:Al3+、NH4+、Cl-、CO32-
的溶液中:Al3+、NH4+、Cl-、CO32-
D. 由下列短周期元素性质的数据推断元素⑤最高价氧化物对应的水化物酸性最强
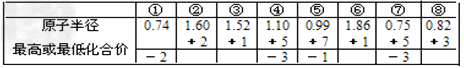
参考答案:D
本题解析:
本题难度:一般
3、选择题 在某无色透明的酸性溶液中,能共存的离子组是( )
A.Na+ 、K+、SO42-、HCO3-
B.Cu2+、K+、SO42-、NO 3-
3-
C.Na+、 K+、Cl-、 NO3-
D.Fe3+、K+、SO42-、Cl-