1、选择题 下列物质分离方法不正确的是
A.分离铁屑与水的混合物——倾析法
B.分离铜离子和铁离子的混合物——纸层析法
C.分离溴和水的混合物——分液法
D.分离硝酸钾和氯化钠的混合物——结晶法
参考答案:C
本题解析:A 正确,分离铁屑与水的混合物——倾析法,也是过滤
B 正确,分离铜离子和铁离子的混合物——纸层析法
C 错误,分离溴和水的混合物——萃取法
D 正确,分离硝酸钾和氯化钠的混合物——结晶法
本题难度:一般
2、选择题 有机物甲的结构简式如下,它可通过不同的化学反应分别制得结构简式为A~G的物质
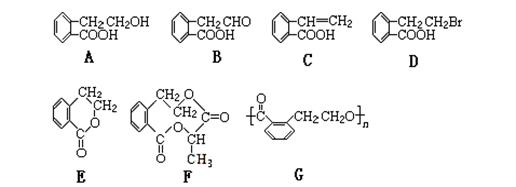
请回答下列问题:
小题1:指出反应的类型:A→C:??A→D:?;
小题2:A-G中可看作酯类的是?。(填代号,下同)
小题3:已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有原子有可能都在同一平面内的物质是?。
参考答案:
小题1:消去?取代(卤代)
小题2: E、F、G?
小题3:C?(各2分)
本题解析:(1)考查有机反应类型的判断。A中含有醇羟基和羧基,而C中含有碳碳双键,说明醇羟基发生了消去反应。D中含有溴原子,说明发生的是醇和溴化氢的取代反应。
(2)考查官能团的判断和有机物的分类。含有酯基的就可以看作是酯类,根据结构简式可知E、F、G含有酯基,可以看作是酯类。
(3)考查有机物结构特点的判断。HCHO分子中所有原子都在同一平面内,所以羧基中所有原子是共平面的。又因为苯环和碳碳双键是平面型结构,所有C中的所有原子是可能同一平面内。只要含有饱和碳原子,则其所有的原子就不可能在同一个平面内。
本题难度:一般
3、选择题 向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
?
| 操作
| 现象
| 结论
|
A
| 滴加BaCl2溶液
| 生成白色沉淀
| 原溶液中有SO42-
|
B
| 滴加氯水和CCl4,振荡、静置
| 下层溶液显紫色
| 原溶液中有I-
|
C
| 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
| 试纸不变蓝
| 原溶液中无NH4+
|
D
| 加入稀盐酸,将产生的气体通入澄清石灰水中
| 溶液变浑浊
| 原溶液中一定含有CO32-
|
?
参考答案:B
本题解析:A. Ba2++ SO42-=BaSO4↓;Ba2++ SO32-=BaSO3↓;Ba2++ CO32-=BaCO3↓.可见能与Ba2+产生白色沉淀的不仅仅是SO42-。错误。B.Cl2+2I-=2Cl-+I2. I2容易溶解在CCl4中而使溶液呈紫色。正确。C.如果溶液含有NH4+,但溶液比较稀或者未加热,也不能产生氨气,故不能使湿润红色石蕊试纸变蓝。错误。D.H++ HCO3-=H2O+CO2↑. 2H++ CO32-=H2O+CO2↑. 2H++ SO32-=H2O+SO2↑。所以加入稀盐酸,将产生的气体通入澄清石灰水中,使溶液变浑浊,那么溶液中不移动含有CO32-。错误。42-、I-、NH4+、CO32-等离子鉴定的知识。
本题难度:一般
4、填空题 海水是宝贵的自然资源.利用海水水可以得到一系列产品.也可以进行废气处理。
(1)利用氯碱工业产品处理含SO2的烟气的流程如下:
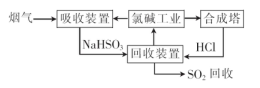
①“吸收装置”中发生反应的离子方程式是?.
②上述流程中循环利用的物质是?。
(2)利用海水脱硫可以有效地解决煤燃烧排放的SO2造成的一系列环境问题。其工艺流程如图所示:
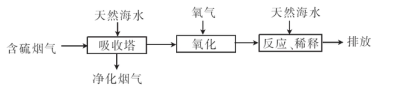
天然海水吸收含硫的烟气后.需要用氧气进行氧化处理.其反应原理的化学方程式是?;氧化后的海水需要加入氢氧化钠.与之混合后才能排放.该操作的主要目的是?。
(3)从海水中捉纯粗盐后的母液中含有K+、Na+、Mg2+等阳离子.对母液进行一系列的加工可制得金属镁。
①从离子反席的角度思考.在母液中加入石灰乳所起的作用是?。
②要利用MgCl2·6H2O制得尢水氯化镁.应采取的措施是?。
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁.下列物质中可以用作镁蒸气的冷却剂的是?(填字母)。
A.Ar?B.CO2?C 空气?D.O2? E.水蒸气
参考答案:
(1)①SO2+OH-=HSO?②NaCl
(2)2H2SO3+O2=2H2SO4;氢氧化钠与硫酸发生中和反应
(3)①沉淀Mg2+[或制取Mg(OH) 2]?②在HCl气流中脱水,抑制MgCl2水解?③A
本题解析:(1) ①氯碱工业反应的化学方程式为:2NaCl+H2O 2NaOH+H2↑+Cl2↑.溶液的主要成分是NaOH。将含SO2的烟气通入该溶液时发生反应:SO2+2NaOH=Na2SO3+H2O ;SO2过量时发生SO2+NaOH=NaHSO3。相应的离子方程式为:SO2+2OH-=SO32-+H2O;SO2+OH-=HSO3-。②由流程图可以看出:在上述流程中循环利用的物质是NaCl。(2)用氧气进行氧化处理吸收含硫的烟气后天然海水的反应原理的化学方程式是2H2SO3+O2=2H2SO4;氧化后的海水含有硫酸,水溶液显酸性,所以需要加入氢氧化钠.与之混合后才能排放.该操作的主要目的是使氢氧化钠与硫酸发生中和反应。(3)①在母液中加入石灰乳所起的作用是使Mg2+转化为Mg(OH) 2沉淀除去。②MgCl2是强酸弱碱盐,加热时盐会弱碱在结晶水中,盐发生水解反应产生Mg(OH) 2和HCl,HCl随着水分的蒸发而挥发,最后得到的是Mg(OH) 2固体。元素要利用MgCl2·6H2O制得无水氯化镁.应采取的措施是在HCl气流中脱水,来抑制MgCl2水解。③由于Mg活动性很强,在高温时容易与空气中的O2及水蒸气发生反应,也能与CO2发生反应产生MgO和C。所以要在惰性气体Ar的环境中冷却。选项为A。2造成的危害的治理方法及电解法冶炼Mg的有关问题的知识。
2NaOH+H2↑+Cl2↑.溶液的主要成分是NaOH。将含SO2的烟气通入该溶液时发生反应:SO2+2NaOH=Na2SO3+H2O ;SO2过量时发生SO2+NaOH=NaHSO3。相应的离子方程式为:SO2+2OH-=SO32-+H2O;SO2+OH-=HSO3-。②由流程图可以看出:在上述流程中循环利用的物质是NaCl。(2)用氧气进行氧化处理吸收含硫的烟气后天然海水的反应原理的化学方程式是2H2SO3+O2=2H2SO4;氧化后的海水含有硫酸,水溶液显酸性,所以需要加入氢氧化钠.与之混合后才能排放.该操作的主要目的是使氢氧化钠与硫酸发生中和反应。(3)①在母液中加入石灰乳所起的作用是使Mg2+转化为Mg(OH) 2沉淀除去。②MgCl2是强酸弱碱盐,加热时盐会弱碱在结晶水中,盐发生水解反应产生Mg(OH) 2和HCl,HCl随着水分的蒸发而挥发,最后得到的是Mg(OH) 2固体。元素要利用MgCl2·6H2O制得无水氯化镁.应采取的措施是在HCl气流中脱水,来抑制MgCl2水解。③由于Mg活动性很强,在高温时容易与空气中的O2及水蒸气发生反应,也能与CO2发生反应产生MgO和C。所以要在惰性气体Ar的环境中冷却。选项为A。2造成的危害的治理方法及电解法冶炼Mg的有关问题的知识。
本题难度:一般
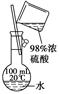
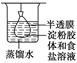
5、选择题 根据实验目的判断下列实验操作或装置正确的是(?)
选项
| A
| B
| C
| D
|
目的
| 实验室制O2
| 配制稀硫酸溶液
| 在铁制品上镀铜
| 净化精制淀粉胶体
|
装置
或操作
| 
| 
| 
| 
|
?
参考答案:D
本题解析:A中长颈漏斗应插入液面以下,其目的是防止气体逸出;B中稀释浓H2SO4应在烧杯中进行;C中铁上镀铜时,Cu片应作阳极而待镀铁制品应作阴极。
本题难度:一般