1、选择题 25℃时,已知弱酸的电离常数:K(CH3COOH)=1.8×10-5;K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8。则下列说法正确的是(? )
A.25℃时,0.1mol/L的醋酸溶液比0.01mol/L的醋酸溶液的K值小
B.25℃时,甲基橙滴入0.1mol/L的醋酸溶液中,溶液呈黄色
C.新制氯水与碳酸氢钠不反应
D.等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH:pH[Na2CO3(aq)]>pH[NaClO(aq)]>pH[CH3COONa(aq)]
参考答案:D
本题解析:A项因为温度不变,0.1mol/L的醋酸溶液与0.01mol/L的醋酸溶液的K值相等;B项甲基橙滴入0.1mol/L的醋酸溶液中,溶液呈红色,黄色是pH>4.4;C项新制氯水主要有盐酸、次氯酸、氯气,盐酸与碳酸氢钠反应;D项根据酸越弱,对应盐的水解程度越大,因为醋酸酸性强于次氯酸强于碳酸氢根离子,则等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH:pH[Na2CO3(aq)]>pH[NaClO(aq)]>pH[CH3COONa(aq)],正确。
点评:综合考查了溶液中电解质的电离、水解等知识,属于中等难度。
本题难度:一般
2、填空题 (10分)某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为 ,浓度是 mol·L-1;由②可知存在的离子为 ,浓度是 mol·L-1;由③可知存在的离子为 ,浓度是 mol·L-1。
(2)该溶液中一定不存在的离子是 (填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
参考答案:(1)NH4+ 0.2;Al3+ 0.2;SO42- 0.5
(2)Fe3+、Mg2+、Ba2+、CO32-
(3)已知的NH4+、Al3+的正电荷总量小于SO42-负电荷总量,依据电荷守恒,一定有K+存在。
本题解析:(1)与氢氧化钠溶液反应产生气体,说明原溶液中含有铵根离子,所以由①可知存在的离子为NH4+,100mL溶液中含有0.02mol NH4+,则铵根离子的浓度是0.2 mol·L-1;因为加入过量氢氧化钠溶液无沉淀生成,说明原溶液中不存在Fe3+、Mg2+,通入过量二氧化碳后有沉淀生成,说明原溶液中存在Al3+,1.02g的固体是氧化铝,物质的量是0.01mol,则Al3+的浓度是0.01mol×2/0.1L=0.2mol/L;由③可知原溶液中存在SO42-,11.65g固体是硫酸钡的质量,其物质的量是0.05mol,所以SO42-的浓度是0.05mol/0.1L=0.5mol/L;
(2)根据以上分析,硫酸根离子的存在,则一定不存在Ba2+,Al3+离子的存在,则一定不存在CO32-,因为加入过量氢氧化钠溶液无沉淀生成,说明原溶液中不存在Fe3+、Mg2+,所以原溶液中肯定不存在的是Fe3+、Mg2+、Ba2+、CO32-
(3)根据溶液呈电中性的原理,此时溶液中的负电荷浓度是0.5mol/L×2=1mol/L,正电荷的浓度是0.2+0.2×3=0.8mol/L<1mol/L,所以一定含有K+。
考点:考查溶液中离子的判断与计算
本题难度:一般
3、选择题 下列说法错误的是
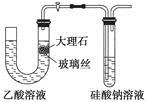
A.使用如图所示装置验证Ka(CH3COOH)>Ka(H2CO3)>Ka(H2SiO3)
B.0.1 mol·L-1的醋酸中加入水或加入冰醋酸均可使平衡向电离方向移动
C.等物质的量浓度的CH3COONa和Na2CO3溶液,后者溶液中水的电离程度大
D.等pH的醋酸和碳酸,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积少
参考答案:A
本题解析:由于乙酸具有挥发性,而图示中没有除杂装置,故无法比较它们的电离常数,选项A错;根据勒夏特列原理可知选项B正确;根据水解原理——“越弱越易水解”可知选项C正确;选项D可用作图法得出是正确的。
本题难度:一般
4、选择题 金属镁和0.1mol·L-1的HCl反应制取氢气,反应速率过快不易收集。为了减缓反应速率,又不减少产生氢气的量,加入下列试剂不能达到上述要求的是
A.硫酸钠溶液
B.醋酸钠固体
C.碳酸钠固体
D.水
参考答案:C
本题解析:
【错解分析】本题的误区之一是认为碳酸钠也可达到上述要求,由于当盐酸转化为碳酸后,本身碳酸是一种易分解的弱酸,而且二氧化碳在水中、酸中的溶解度较小。因此,氢离子的物质的量将减少,不能满足题目的要求,选项C是正确答案。本题的另一误区是,由于思维定势只顾硫酸钠不起作用,忽略了溶液中的水起到稀释氢离子浓度的作用,选项A不为本题的答案。
【正解】盐酸是强电解质,在水中全部电离,氢离子浓度较大,反应速率较快。为了减缓反应速率,又不减少产生氢气的量,只能降低氢离子浓度,而又不改变氢离子的物质的量。一种方法是加水稀释;另一种方法是加入弱酸盐(如醋酸钠),使强酸转化为弱酸。弱酸部分电离,氢离子浓度有所下降,反应速率减缓,而酸提供的氢离子物质的量又不变。
本题难度:简单
5、选择题 下列各组离子在溶液中不能大量共存的是( )
A.Na+、CO32-、Ba2+、OH-
B.Cu2+、Na+、NO3-、SO42-
C.Na+、K+、Cl-、HCO3-
D.K+、Na+、NO3-、Cl-
参考答案:A.CO32-与Ba2+反应生成BaCO3沉淀而不能大量共存,故A选;
B.离子之间不发生任何反应,可大量共存,故B不选;
C.离子之间不发生任何反应,可大量共存,故C不选;
D.离子之间不发生任何反应,可大量共存,故D不选.
故选A.
本题解析:
本题难度:一般