1、填空题 等质量的氧气(O2)和臭氧(O3),物质的量之比为?,所含氧原子的个数之比为?
参考答案:3:2?、? 1:1
本题解析:根据n=m/M可知在质量相等的条件下,物质的量和摩尔质量成反比,即二者的物质的量之比是48︰32=3︰2。由于都是由氧原子形成的单质,所以所含氧原子的个数之比为1︰1。
本题难度:一般
2、选择题 NA代表阿伏加德罗常数的数值,下列说法正确的是
A.标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
B.常温下,42 g丁烯和环丙烷的混合气体中含有的σ键数目为3NA
C.常温下,1mol SiC中含有Si-C键的数目为4 NA
D.常温常压下,17g甲基(—14CH3)所含的中子数为9NA
参考答案:C
本题解析:A项:氯仿在标准状况下为液态,不适合气体的摩尔体积,排除
B项:一个丁烯分子含有12个σ键,而环丙烷含有9个σ键,故42 g丁烯和环丙烷的混合气体中含有的σ键数目无法确定
C项:正确
D项:17g甲基(—14CH3)所含的中子数为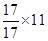 NA,排除
NA,排除
本题难度:一般
3、选择题 如图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是

A.化学反应中分子的种类发生了改变
B.该反应类型是分解反应
C.反应生成的丙物质属于单质
D.根据阿伏加德罗定律可推知,1个乙分子中含有2个A原子
参考答案:D
本题解析:已知2个甲分子反应生成1个丙分子和3个乙分子,根据阿伏伽德罗定律和质量守恒定律知1个乙分子中含有2个A原子。D正确。
本题难度:一般
4、选择题 下列说法正确的是( )
A.把100mL3mol?L-1的H2SO4跟100mLH2O混合,硫酸的物质的量浓度改变为1.5mol?L-1
B.把200mL3mol?L-1的BaCl2溶液跟100mL3mol?L-1的KCl溶液混合后,溶液中的C(Cl-)仍然是3mol?L-1
C.把100g20%的NaCl溶液跟100gH2O混合后,NaCl溶液的质量分数是10%
D.把100mL20%的NaOH溶液跟100mLH2O混合后,NaOH溶液的质量分数是10%
参考答案:A、稀释前后溶质硫酸的物质的量不变,混合溶液体积小于200ml,所以稀释后硫酸的物质的量浓度大于为
1.5mol?L-1,故A错误;
B、3mol?L-1的BaCl2溶液中氯离子浓度为6mol/L,3mol?L-1的KCl溶液中氯离子浓度为3molL,氢离子浓度介于3mol/L~6mol/L,若忽略体积变化,混合后氯离子浓度约为0.2L×6mol/L+0.1L×3mol/L0.3L=5mol/L,故B错误;
C、混合后溶液质量为200g,溶质氯化钠的质量不变为100g×20%=20g,所以混合后氢氧化钠溶液质量分数为
20g200g×100%=10%,故C正确;
D、水的密度小于氢氧化钠溶液密度,混合后溶液的质量小于2倍的100mL20%的氢氧化钠溶液质量,所以混合后的氢氧化钠溶液的质量分数大于10%,故D错误.
故选:C.
本题解析:
本题难度:简单
5、选择题 硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4 mol/L,硫酸根离子浓度为0.7 mol/L,则K+的物质的量浓度为
A.0.1 mol/L
B.0.15 mol/L
C.0.3 mol/L
D.0.2 mol/L
参考答案:D
本题解析:由于溶液是电中性的,所以K+的物质的量浓度为0.7 mol/L×2-0.4 mol/L×3=0.2 mol/L,答案选D。
点评:做这种类型的试题必须紧紧抓住电荷守恒定律这一关系式。
本题难度:一般