1、选择题 下列实验设计、操作或分析合理的是
①完成中和热测定的实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替;
②实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂;
③在测定硫酸铜晶体的结晶水含量时,加热过程中不慎有晶体飞溅出来,将会造成测定结果偏高;
④用食醋和澄清石灰水验证蛋壳中含有碳酸盐;
⑤用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子.
A.②③④
B.①③⑤
C.①②④
D.②③⑤
参考答案:A
本题解析:
本题难度:简单
2、选择题 按下列实验方案能达到要求的是
A.用托盘天平称量25.20 g NaCl固体
B.用100 mL量筒量取2.50 mL稀盐酸
C.用酸式滴定管量出11.40 mL 0.1 mol·L-1的盐酸
D.用250 mL容量瓶配制0.1 mol·L-1 150 mL盐酸
参考答案:C
本题解析:A项,托盘天平称量固体物质其精确度为0.1g,错误;B项,100mL的量筒量取液体体积其精确度为0.1mL,;C项,酸式滴定管量液体的体积其精确度为0.01 mL,正确;D项,250 mL容量瓶只能配置250 mL的溶液,错误。
本题难度:简单
3、选择题 欲萃取碘水中的I2,不能作为萃取剂的是(?)
A.苯
B.酒精
C.CCl4
D.汽油
参考答案:B
本题解析:略
本题难度:简单
4、选择题 下列根据实验操作和现象所得出的结论正确的是
选项
| 实验操作
| 实验现象
| 结 论
|
A
| 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液
| 出现白色沉淀
| 溶液X中一定含有SO42-
|
B
| 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体
| HA放出的氢气多且反应速率快
| HB酸性比HA强
|
C
| 溴乙烷与NaOH溶液共热后,滴加AgNO3溶液
| 未出现淡黄色沉淀
| 溴乙烷未发生水解
|
D
| 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热
| 未出现砖红色沉淀
| Y中不含有醛基
|
?
参考答案:B
本题解析:A不能排除SO32-离子的干扰,错误;B中等体积等PH值,弱酸中在反应过程中氢离子浓度较大,反应速率快,正确;C溴乙烷与NaOH溶液共热后溶液呈碱性,会和硝酸银发生反应,正确操作方法加硝酸中和后,再滴加AgNO3溶液,错误;D向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,由于NaOH溶液较少溶液呈酸性,必须是新制的氢氧化铜悬浊液呈碱性才能氧化酫基,错误;
本题难度:一般
5、选择题 下列实验操作能够达到实验目的的是(?)
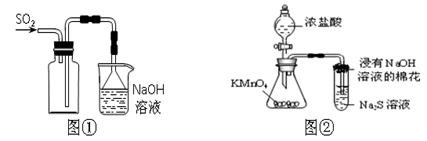
A.实验室采用图①所示装置收集SO2
B.可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱
C.实验室制取的溴乙烷中常含有少量溴,加适量的苯,振荡、静置后分液,可除去溴乙烷中的溴
D.称取0.40 g NaOH,置于100 mL容量瓶中加水至刻度线,可配制0.10 mol/L NaOH溶液
参考答案:B
本题解析:考查常见的基本操作。SO2的密度大于空气的,应该是长口进,短口出,选项A不正确;溴乙烷和苯也是易溶的,不能作为萃取剂,选项C不正确;容量瓶不能用来溶解或稀释溶液,选项D不正确,因此正确的答案选B。
本题难度:一般