1、填空题 在200℃时,将amolH2(g)和bmolI2(g)充入到体积为VL的密闭容器中,发生反应:
I2(g)+H2(g)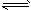 2HI(g)
2HI(g)
(1)反应刚开始时,由于C(H2)=_______,C(I2)=_______,而C(HI)=_______,所以化学反应速率_______最大,而_______最小(为零)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为C(H2)_______,C(I2)_______,而
C(HI)_______,从而化学反应速率ν(正)_______,而ν(逆)_______。
(3)当反应进行到ν(正)与ν(逆)_______时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将_______。
参考答案:(1)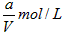 ;
;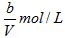 ;0;ν(正);ν(逆)
;0;ν(正);ν(逆)
(2)减小;减小;增大;减小;增大
(3)相等;保持不变
本题解析:
本题难度:一般
2、选择题 下列反应中生成H2的速率最快的是
[? ]
金属
酸溶液
温度?
A.
Mg
0.5mol·L-1 H2SO4
20℃
B.
Fe
1?mol·L-1 HCl
20℃
C.
Zn
2?mol·L-1 HCl
30℃
D.
Mg
1?mol·L-1 H2SO4
30℃
参考答案:D
本题解析:
本题难度:一般
3、计算题 (1)将不同量的CO(g)和H2O(g)分别通入体积2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 6
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
①实验1中以v(CO2)表示的平均反应速率为 (第二位小数)。
②该反应为 (填“吸热”或“放热”)反应。
③求实验2的平常常数K,要求写出计算过程,结果取二位小数。
(2)已知在常温常压下:

写出甲醇不完全燃烧生成CO和液态水的热化学方程式 。
(3)甲醇和氧气完全燃烧的反应可以设计为燃料电池,装置如图,该电池通过K2CO3溶液吸收反应生的CO2。则负极的电极反应为 。

(4)CaCO3的KSP=2.8×10¯9。将等体积CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10¯4mol/L,则生成沉淀所需该CaCl2溶液的最小浓度为 。
参考答案:(16分)
(1) ①0.13mol/(L·min) (3分) ②放热 (2分)
③ CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 1 0.5 0 0
变化浓度(mol/L) 0.2 0.2 0.2 0.2
平衡浓度(mol/L) 0.8 0.3 0.2 0.2
所以,K=(0.2×0.2)/(0.8×0.3)= 0.17 (4分,三行式2分,表达式1分,答案1分)
(2)CH3OH(l) + O2(g) =" CO(g)" + 2H2O(l) (2分)ΔH=-442.8 kJ
本题解析:
本题难度:一般
4、选择题 某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)  4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是(?)
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是(?)
A.前2 min,D的平均反应速率为0.2 mol/(L·min)
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡不移动
D.增加B,平衡向右移动,B的平衡转化率增大
参考答案:B
本题解析:由方程式可知,当反应生成1.6 mol C时,同时生成0.4 mol D,则:
3A(g)?+? 2B(g)  4C(s)+D(g)
4C(s)+D(g)
起始: 2 mol/L ?1 mol/L?0
变化: 0.6 mol/L ?0.4 mol/L ?0.2 mol/L
平衡: 1.4 mol/L ?0.6 mol/L?0.2 mol/L
故前:2 min,D的平均反应速率为:
 =0.1? mol/(L·min),
=0.1? mol/(L·min),
B的转化率: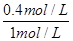 ×100%=40%;由于C为固体,故增大压强,平衡正移;增加B,平衡向右移动,A的转化率增大,但B的转化率降低。
×100%=40%;由于C为固体,故增大压强,平衡正移;增加B,平衡向右移动,A的转化率增大,但B的转化率降低。
本题难度:一般
5、选择题 过量的锌粉跟100mL 6mol/L H2SO4反应,在一定温度下,为了减缓反应速率但又不影响生成氢气的总量。加入下列物质不能达到上述目的的是(?)
A.把锌粉改为锌粒
B.水
C.Na2CO3固体
D.降低反应体系温度
参考答案:C
本题解析:锌过量,产生氢气的速率决定于氢离子浓度,产生氢气总量决定于硫酸物质的量。锌粉改为锌粒,金属与酸接触面积减小,反应速率减小,但氢气总量不变,A正确;加水稀释,硫酸浓度减小,化学反应速率减小,但硫酸物质的量不变,氢气总量不变,B正确;加碳酸钠溶液,碳酸钠与硫酸反应,氢离子浓度减小,反应速率减小,硫酸物质的量减小,氢气总量减少,C错误;降低体系温度,化学反应速率减慢,但硫酸物质的量不变,产生氢气总量不变,D正确。
点评:过量锌与硫酸反应,产生气体的速率决定于氢离子浓度,产生的氢气的总量决定于硫酸物质的量。
本题难度:一般