| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《离子共存》答题技巧(2019年最新版)(十)
参考答案:C 本题解析:A中NH4+、OH-不能大量共存; 本题难度:一般 2、选择题 在离子浓度都为0.1 mol/L的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是( ) |
参考答案:B
本题解析:A.物质的氧化性强弱顺序是:Fe3+>Cu2+>H+在含Fe3+、Cu2+、H+,所以溶液中加入锌粉发生反应先后顺序:Fe3+、Cu2+、H+,错误;B.结合H+的能力大小关系是:在含OH—、AlO2—、SO32—,所以溶液中逐滴加入硫酸氢钠溶液发生反应先后顺序:OH—、AlO2—、SO32— ,正确;C.微粒的还原性强弱顺序是: I—、SO32—、Br—,所以溶液中不断通入氯气发生反应先后顺序:I—、SO32—、Br—,错误;D.在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液,发生反应先后顺序H+、Fe3+、NH4+,错误。
考点:考查化学反应的先后顺序的知识。
本题难度:困难
3、填空题 (14分)工业常利用CO来制氢气。已知在25℃时:
C(s,石墨) + 1/2 O2(g) =" CO(g)?" △H1= -111kJ/mol
H2(g) + 1/2 O2(g) = H2O(g)? △H2= -242kJ/mol
C(s,石墨) + O2(g) = CO2(g)? △H3= -394kJ/mol
(1)在25℃时,CO(g) + H2O(g)  ?CO2(g) + H2(g)? △H=_____________。
?CO2(g) + H2(g)? △H=_____________。
(2)在2L密闭容器中,将2 mol CO与3 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g)? K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
CO2(g)+H2(g)? K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
(3)将(2)中的平衡后的混合气体通入300mL 6mol/L NaOH溶液中,充分吸收,所得溶液中离子浓度由大到小的顺序为____________________________________ _____________。
_____________。
(4)将(3)中剩余的气体通过足量浓硫酸后,再与足量氧气用电火花引燃后通入足量的过氧化钠中,过氧化钠的质量增重______g。
(5)工业上也可以用CO和H2生产甲醇:CO(g) + 2H2 (g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变,
(g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变, 增大容器的体积,则平衡_________(填字母)
增大容器的体积,则平衡_________(填字母)
A.不移动
B.向正反应方向移动
C.向逆反应方向移动
D.无法判断移动的方向
参考答案: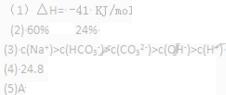
本题解析:略
本题难度:一般
4、计算题 酸、碱、盐是化学工作者研究的重要领域,请回答下列各小题:(1)某二元酸H2X的电离方程式是:H2X=H++HX—,HX— X2—+H+。回答下列问题:
X2—+H+。回答下列问题:
①KHX溶液显?(填“酸性”、“碱性”或“中性”)。
②若0.1 mol·L—1KHX溶液的pH=2,则0.1 mol·L—1H2X溶液中氢离子的物质的量
浓度?(填“<”、“>”或“=”)0.11 mol·L—1,理由是?。 ?
③0.01 mol·L—1的HCl与0.02 mol·L—1的KHX溶液等体积混合液中各离子浓度由大到小的顺序是? (2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成?(填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成?(填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(3)在25℃下,有pH=3的醋酸溶液和pH=11的氢氧化钠溶液,其中氢氧化钠溶液的物质的量浓度是?,醋酸溶液的物质的量浓度?(填“>”、“<”、“=”)氢氧化钠溶液物质的量浓度。将上述两溶液等体积混合,反应后溶液显?(填“酸”、“碱”、“中”)性。
(4)某强酸性反应体系中,发生反应:
?X+?PbO2+?H2SO4 =?Pb(MnO4)2+?PbSO4+?H2O ,
已知X是一种硫酸盐,且0.2 mol X在该反应中失去1 mol 电子,则X的化学式是?
?。请将上述化学方程式配平,把系数填在各物质前的横线上。.
参考答案:29.(14分)
(1)①酸性(1分)
②<?(1分) H2X第一步电离产生的H+对HX—的电离起了抑制作用(2分)
③c(K+)>c(HX—)>c(H+)> c(Cl—)>c(X2—)>c(OH—) (2分)
(2)Fe(OH)3(1分)?
(3)0.001 mol·L—1(1分) >(1分) 酸(1分)
(4)2X+5PbO2+2H2SO4 = Pb(MnO4)2+4PbSO4+2H2O (2分)
MnSO4(2分)
本题解析:
(1)①某二元酸H2X的电离方程式是:H2X=H++HX—,HX— X2—+H+。第一步是完全电离,第二步是可逆反应,说明是HX—弱电解质,因此HX—只能电离呈酸性;
X2—+H+。第一步是完全电离,第二步是可逆反应,说明是HX—弱电解质,因此HX—只能电离呈酸性;
②H2X是强电解质,第一步是完全电离所以溶液中氢离子的物质的量浓度比较大。
③0.01 mol·L—1的HCl与0.02 mol·L—1的KHX溶液等体积混合液中各离子浓度由大到小的顺序是c(K+)>c(HX—)>c(H+)> c(Cl—)>c(X2—)>c(OH—)
(2)由于Fe(OH)3的KSP比较小,当OH-浓度相同时首先沉淀的是Fe(OH)3。
(3)由于醋酸是弱酸,虽然H+和OH-浓度开始相同时,醋酸的物质的量浓度应该比较大,等体积中和之后酸是过量的,所以呈酸性。
(4)根据电子守恒和原子守恒不难得出2X+5PbO2+2H2SO4 = Pb(MnO4)2+4PbSO4+2H2O X应该是MnSO4。
本题难度:困难
5、选择题 甲、乙、丙是三种不含相同离子的可溶性电解质。它们所含的离子如下表所示:
| 阳离子 | NH4+、Na+、Mg2+ |
| 阴离子 | OH—、NO3—、SO42— |
参考答案:D
本题解析:由于这三种溶液中含有的离子种类不同,而且等质量的三种化合物配制相同体积的溶液,其物质的量浓度:c(甲)>c(乙)>c(丙),Mg(OH)2难溶,NH3·H2O是弱电解质,则甲是NaOH;乙是NH4NO3;丙是MgSO4。或甲是NaOH;乙是(NH4)2SO4;丙是Mg (NO3)2。因此错误的是D。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《反应热计算.. | |