1、简答题 (12 分)硫酸钠-过氧化氢加合物(xNa2SO4 ·yH2O2 ·zH2O)的组成可通过下列实验测定:①准确称取1. 7700 g 样品,配制成100. 00 mL 溶液A。②准确量取25. 00 mL 溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0. 5825 g。③准确量取25. 00 mL 溶液A,加适量稀硫酸酸化后,用0. 02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25. 00 mL。H2O2与KMnO4反应的离子方程式如下:2MnO4- +5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp ="1." 1伊10-10,欲使溶液中c(SO42- )≤1. 0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥?mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO4- 被还原为MnO2,其离子方程式为?。
(3)通过计算确定样品的组成(写出计算过程)。
参考答案:(1)1. 1×10-4
(2)2MnO4-+3H2O2=2MnO2↓+3O2↑+2OH-+2H2O
(3)n(Na2SO4)= n(BaSO4)=" 0." 5825g/233g·mol-1 ="2." 50×10-3 mol
2MnO4- +5H2O2+6H+=2Mn2++8H2O+5O2↑
n(H2O2)= 5/2×0. 02000 mol·L-1×25. 00 mL/1000 mL·L-1 ="1." 25×10-3mol
m(Na2SO4)=" 142" g·mol-1×2. 50×10-3 mol="0." 355 g
m(H2O2)=" 34" g·mol-1×1. 25×10-3 mol="0." 0425 g
n(H2O)=(1. 7700 g×25. 00 mL/100. 00mL-0. 355 g-0. 0425 g)/18 g·mol-1 ="2." 50×10-3mol
x :y :z =n(Na2SO4) :n(H2O2) :n(H2O)=" 2" :1 :2
硫酸钠-过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O
本题解析:(1)根据Ksp可得出c(Ba2+)=Ksp/c(SO42-)=1.1×10-10/1.0×10-6="1." 1×10-4。(2)根据条件可知,非酸性条件下,MnO4-被还原为MnO2,则H2O2被氧化,产物只能为O2,根据得失电子守恒,确定出MnO4- 和H2O2前的系数,再根据电荷守恒,确定出产物中含有OH-。(3)由②组数据可知沉淀为BaSO4,根据元素S守恒,可得出:n(Na2SO4)= n(BaSO4)=" 0." 5825g/233g·mol-1 ="2." 50×10-3 mol;由③组数据,在结合反应2MnO4— +5H2O2+6H+==2Mn2++8H2O+5O2↑,可得出n(H2O2)= 0.02mol/L×25×10-3L×5/2=1.25×10-3mol;再根据样品的质量,通过质量的关系得出样品中H2O的质量,进一步得出n(H2O),即m(Na2SO4)=" 142" g·mol-1 ×2. 50×10-3 mol="0.355" g ,m(H2O2)=" 34" g·mol-1 ×1. 25×10-3 mol="0." 0425 g,所以n(H2O)="[1." 7700 g×25. 00 mL/100. 00mL-0. 355 g-0. 0425 g]/18g·mol-1 =2.50×10-3mol,故有:x:y:z=n(Na2SO4):n(H2O2):n(H2O)= 2:1:2。所以,硫酸钠-过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O。
【考点定位】物质组成的定量检测
本题难度:一般
2、简答题 除去下列物质中所含少量杂质的所选试剂不正确的是( )
| 物?质 | 杂?质 | 试?剂
A
Cl2
HCl
饱和食盐水
B
CO2
HCl
饱和Na2CO3溶液
C
金属镁
金属铝
稀NaOH溶液
D
FeCl2
FeCl3
铁粉
|
A.A
B.B
C.C
D.D
参考答案:A、Cl2不溶于饱和食盐水,而HCl溶于饱和食盐水,所以可以除杂,故A正确;
B、CO2气体中含有少量HCl气体,加入饱和Na2CO3溶液,CO2能与饱和Na2CO3溶液会把二氧化碳也除去,所以不可以除杂,故B错误;
C、金属镁与稀NaOH溶液不反应,金属铝能与稀NaOH溶液反应,所以可以除杂,故C正确;
D、FeCl3能与铁粉反应生成FeCl2,FeCl2与铁粉不反应,因此可以除杂,故D正确;
故选:B.
本题解析:
本题难度:一般
3、选择题 下列实验操作中正确的是
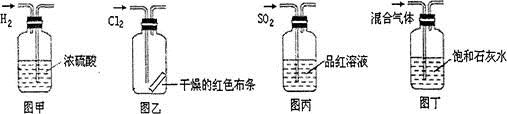
A.图甲所示,可得到干燥的氢气
B.图乙所示,可以验证氯气的漂白性
C.图丙所示,可以验证SO2的漂白性
D.图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2
参考答案:D
本题解析:A中不能得到干燥的氢气,因为进入管短,会把浓硫酸从长导管中压出,A错;布条是干燥的,无漂白性,B错;二氧化硫能使品红溶液褪色,证明二氧化硫的漂白性,C正确;能使澄清石灰水变浑浊不光是二氧化碳,也可能是二氧化硫,D错。答案选C。
本题难度:一般
4、实验题 氯化钠样品中含有少量的Na2SO4和Na2CO3,按下列流程进行净化。
(1)请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称。

(2)写出有关反应的化学方程式:
第②步________________
第③步________________
第⑤步________________
参考答案:(1)①蒸馏水 溶解 ②BaCl2溶液 ③Na2CO3溶液 ④过滤 ⑤稀盐酸 ⑥蒸发结晶
(2)②Na2SO4+BaCl2====BaSO4↓+2NaCl,Na2CO3+BaCl2====BaCO3↓+2NaCl
③BaCl2+Na2CO3====BaCO3↓+2NaCl
⑤NaCO3+2HCl====2NaCl+H2O+CO2↑
本题解析:硫酸钠和碳酸钠可以选用钡离子除去,为不引入新的杂质,故选用氯化钡溶液,为使硫酸根离子和碳酸根离子充分沉淀,所加的氯化钡溶液需过量
本题难度:简单
5、实验题 (16分)某只含有CaCl2和Na2SO4杂质的粗盐样品,加水得到混合物A后,某实验小组的同学设计了如下实验步骤,请按要求回答有关问题。
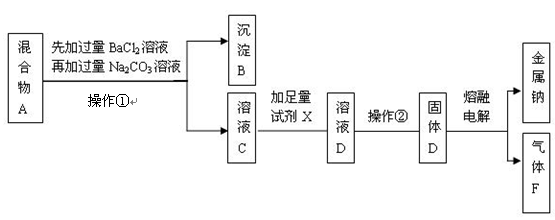
(1)在混合物A中先加过量的BaCl2溶液除去的离子是??;充分搅拌后,再加过量的Na2CO3溶液可除去的离子是??。
(2)在溶液C中加入的足量试剂X是 ?。
(3)操作②的分离方法分别是?。
(4)漂白液的有效成分是NaClO,可用气体F与NaOH溶液反应制得,该反应的化学方程式为?。
参考答案:(1)SO42-;Ba2+,Ca2+(2)HCl溶液(3)蒸发结晶
(4)Cl2+ 2NaOH="=NaCl" +NaClO +H2O
本题解析:(1)氯化钡能与硫酸钠反应生成硫酸钡沉淀和氯化钠,因此加入氯化钡溶液是除去硫酸钠的;碳酸钠能与氯化钙反应产生碳酸钙沉淀,能与氯化钡反应产生碳酸钡沉淀,因此加入碳酸钠溶液的目的是除去原混合物中的氯化钙以及过量的氯化钡;
(2)溶液C中含有过量的碳酸钠和氯化钠,加入试剂x将碳酸钠转化成氯化钠,因此加入的x是盐酸,反应的化学方程式为2HCl+Na2CO2=2NaCl+CO2↑+H2O;
(3)操作①是将固体与液体分离,用过滤法,操作②是将氯化钠溶液中氯化钠结晶析出,应用蒸发溶剂的方法.
(4)Cl2与NaOH溶液反应方程式为:Cl2+ 2NaOH="=NaCl" +NaClO +H2O。
点评:本题主要考了在粗盐提纯的试验中对杂质进行转换的探究,除去杂质的同时不能引入新的杂质。
本题难度:一般