1、选择题 科学家成功地研制出一种新型的铁铝合金材料.这种材料是在真空中通过熔融铁和铝制成的,其强度与一般钢材相当,且容易加工,能够在高温环境中使用.如果把这种材料完全溶于盐酸中,然后通入过量的氯气,再加入过量的烧碱溶液,溶液中能够存在较多的阳离子是
A.Na+、Fe3+、Al3+、H+
B.Na+、Fe2+、Al3+
C.Na+、Fe3+
D.Na+
参考答案:D
本题解析:正确解法:“过量的氯气”可以排除B选项中的Fe2+,“过量的烧碱溶液”可以排除A、B选项中的Al3+,也可以排除C选项中的Fe3+.
点评:该题就Fe2+的还原性、Al3+和Fe3+在碱性条件下的性质进行设问,考查了同学们提炼有用信息的能力.
本题难度:困难
2、选择题 离子方程式BaCO3+2H+=CO2↑+H2O+Ba2+中的H+不可能来自下列物质中的是
[? ]
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤H2CO3
A.①③
B.①④⑤
C.②④⑤
D.①⑤
参考答案:C
本题解析:
本题难度:简单
3、选择题 将Fe,Cu,Fe2+,Fe3+和Cu2+盛于同一容器中充分反应,如Fe有剩余,则容器中只能有( )
A.Cu,Fe3+
B.Fe2+,Fe3+
C.Cu,Cu2+,Fe
D.Cu,Fe2+,Fe
参考答案:由于铁粉有剩余,金属的还原性为:Fe>Cu,所以金属铜不会参加反应,容器中一定存在铜;能够与铁粉反应有铁离子和铜离子,所以铜离子和铁离子不会存在,与铁粉反应后生成了金属铜和亚铁离子,所以容器中一定存在亚铁离子,即反应后容器中一定存在:Cu,Fe2+,Fe
故选:D.
本题解析:
本题难度:一般
4、填空题 铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强。工业上往往采取下列循环工艺防止铬的污染:
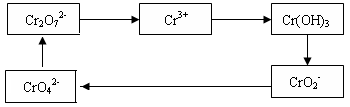
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下:
?Cr2O72- +?Fe3O4 +??H+ →?Cr3+ +?Fe3+ +?H2O
配平上述离子反应方程式,并标出反应中电子转移的方向和数目。
(2)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。写出从该沉淀中分离出Cr(OH)3的离子方程式?、
?。
(3)回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O?② 2S2O32- + I2→S4O62- + 2I-
准确称取纯净的K2Cr2O7 0.1225g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为?(保留四位有效数字)。
参考答案:(1)
 ?(4分,其中配平:2分,标出电子转移方向:1分,数目:1分)
?(4分,其中配平:2分,标出电子转移方向:1分,数目:1分)
(2)Cr(OH)3+OH-→CrO2-+2H2O?(1分)
CrO2- + 2H2O + CO2→Cr(OH)3↓+HCO3-(1分)
(3)0.1000 mol/L(2分,有效数字有错或没有单位扣1分)。
本题解析:(1)根据质量守恒和得失电子守恒不难写出相关化学方程式;
(2)根据反应物和产物,不难写出相关化学方程式:Cr(OH)3+OH-→CrO2-+2H2O ;CrO2- + 2H2O + CO2→Cr(OH)3↓+HCO3-;
(3)根据方程式得到:Cr2O72- -------3I2 ------6S2O32- ×6=0.025L×c(Na2S2O3),c(Na2S2O3)="0.1000" mol/L。
×6=0.025L×c(Na2S2O3),c(Na2S2O3)="0.1000" mol/L。
本题难度:困难
5、选择题 室温时,下列各组离子在指定溶液中可以大量共存的是
A.加入铝片能产生氢气的溶液中:K+、OH-、NO3-、Fe3+
B.无色透明溶液中:K+、Cu2+、SO42-、Na+
C.含有大量AlO2-的溶液中:Na+、OH-、Cl-、CO32-
D.能使pH试纸显红色的溶液中:Na+,NO3-,Fe2+,SO42-
参考答案:C
本题解析:分析:A.加入铝片能产生氢气的溶液,为酸或强碱溶液;
B.Cu2+为蓝色;
C.含有大量AlO2-的溶液,显碱性;
D.能使pH试纸显红色的溶液,显酸性.
解答:A.加入铝片能产生氢气的溶液,为酸或强碱溶液,H+、OH-结合生成水,OH-、Fe3+结合生成沉淀,不能共存,故A错误;
B.Cu2+为蓝色,与无色溶液不符,故B错误;
C.含有大量AlO2-的溶液,显碱性,该组离子之间不反应,能共存,故C正确;
D.能使pH试纸显红色的溶液,显酸性,H+、NO3-、Fe2+发生氧化还原反应,不能共存,故D错误;
故选C.
点评:本题考查离子的共存,明确习题中的信息及离子之间的反应即可解答,注意选项D中的氧化还原反应,题目难度不大.
本题难度:简单