1、选择题 下列卤族元素的有关实验,说法正确的是
A.往稀米粥中加入少量加碘食盐,能检验食盐中是否含碘
B.已知I3-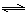 I2+I-,向盛有KI3溶液的试管中加人适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加人适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
C.用溴水即可鉴别苯酚溶液、2,4-己二烯和苯
D.浓盐酸长期暴露在空气中因为见光分解而浓度降低
参考答案:C
本题解析:A:食盐中的碘元素以KIO3的形式存在,与米粥中的淀粉无任何反应及现象;B:CCl4层显紫红色是由于碘单质在其中的溶解度大于在水中的溶解度所致。C:溴水可使苯酚显紫色、与2,4-己二烯褪色、与苯不能褪色但分层,故用溴水即可鉴别三者;D:盐酸为挥发性酸,暴露在空气中因挥发而浓度降低。故选C
本题难度:一般
2、选择题 在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
C.氯水滴在PH试纸上,一段时间后将观察到试纸变红,说明H+存在
D.加入NaOH溶液,氯水浅黄绿色消失,说明有HClO分子存在
参考答案:B
本题解析:略
本题难度:一般
3、实验题 某学生对SO2与漂粉精的反应进行实验探究:
操作
| 现象
|
取适量漂粉精固体,加入100mL水
| 部分固体溶解,溶液略有颜色
|
过滤,测漂粉精溶液的pH
| pH试纸先变蓝,后褪色
|
| 液面上方出现白雾;
稍后,出现浑浊,溶液变为黄绿色;
稍后,产生大量白色沉淀,黄绿色褪去
|
?
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式??;?
(2)向水中持续通入SO2,未观察 到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是?;
②由实验a、b不能判断白雾中含有HC1,理由是?;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是?;
②用离子方程式解释现象iii中黄绿色褪去的原因:?。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I-+ 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
滴定次数
| 1
| 2
| 3
|
KI溶液体积/mL
| 19.98
| 20.02
| 20.00
|
?
该漂白粉中有效成分的质量分数为?。
参考答案:(1)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(2)①验证Cl2存在②与硝酸酸化的AgNO3产生的白色沉淀也可能是Ag2SO4或Ag2SO3
(3)①CaSO4?②SO2+Cl2+2H2O=4H++SO42-+2Cl-?(4)42.90%(4分,数据对且符合有效数字要求)
本题解析:(1)Cl2和Ca(OH)2生成氯化钙、次氯酸钙与水;(2)①反应中生成Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否Cl2,排除Cl2干扰;②白雾中含有SO2,可以被硝酸氧化为硫酸,故SO2可以使酸化的AgNO3溶液产生白色沉淀;(3)①A瓶中混合物过滤、洗涤得沉淀X,向X中加入稀HC1,无明显变化,不含CaSO3。取上层清液,加入BaC12溶液,产生白色沉淀,说明有SO42-。故X中含有的物质是CaSO4;②iii中黄绿色褪去的原因是SO2还原了Cl2的原因:SO2+Cl2+2H2O=4H++SO42-+2Cl-;(4)根据反应原理可知3~2KI,平均消耗KI为20.00mL,为20.00×10-3×0.2000mol=4.000mol,即漂白粉含6.000×10-3mol Ca(C1O)2,即0.8580g,故该漂白粉中有效成分的质量分数为42.90%。
本题难度:困难
4、选择题 下列化台物不能通过单质直接化合而制得的是( )
A.HCl
B.AlCl3
C.FeCl2
D.NaCl
参考答案:A.HCl可由H2和Cl2化合反应生成,故A不选;
B.AlCl3可由Al和Cl2化合反应生成,故B不选;
C.Fe和Cl2化合反应生成FeCl3,不能得到FeCl2,故C错误;
D.NaCl可由Na和Cl2化合反应生成,故D不选.
故选C.
本题解析:
本题难度:一般
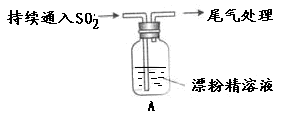
5、填空题 海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图。
按要求回答问题:
(1)浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种。下列物质不需要通过化学变化就能够从海水中获得的是?。
A.食盐?B.金属钠?C.淡水
(2)以电解食盐水为基础制取Cl2、?等产品的工业称为“氯碱工业”。
(3)实验室制取氯气的反应原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气?
MnCl2+Cl2↑+2H2O;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气?
(填写装置的序号)。

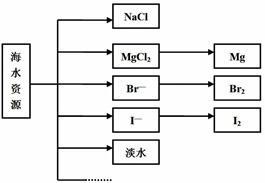
(4)实验室中模拟Br—→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现。写出Br—→Br2的转化离子方程式为:?;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是?(选填下列选项的编号字母)。
(5)电解熔融氯化镁所得的镁蒸气冷却后即为固体镁。下列气体中,镁蒸气可以在其氛围中冷却的是 ? (选填下列选项的编号字母)。
A.Cl2 B.N2 C.Ar D.空气 E.H2
参考答案:(12分)(1)AC? [2分,答对一个给1分,有错不给分]
(2)H2、NaOH? [2分,只写NaOH也给分,写成名称同样给分]
(3) b?[ 2分]
(4)2Br— + Cl2= 2Cl— + Br2, d 。[每空2分]
(5)CE ?[2分,答对一个给1分,有错不给分]
本题解析:(1)海水蒸发浓缩即可以得到食盐。另外海水淡化也是物理变化,金属钠的制备需要通过电解发获得,答案选AC。
(2)以电解食盐水为基础制取Cl2、氢气和氢氧化钠等产品的工业称为“氯碱工业”。
(3)根据反应的化学方程式可知,该反应是固体和液体之间需要加热得到气体的,所以应该选择的装置是b。
(4)氯气具有强氧化性,能把溴离子氧化生成单质溴,则反应的离子方程式是2Br— + Cl2= 2Cl— + Br2。由于氯气在水中的溶解度不大,所以没有必要防止倒吸,但氯气有毒,需要尾气处理,答案选d。
(5)镁是活泼的金属,在加热的条件下,能和空气、氯气以及氮气反应,所以可以冷却镁的是Ar和氢气,答案选CE。
点评:该题是高考中的常见题型,属于基础性试题的考查,侧重对学生基础知识的巩固和训练,主要是考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的实验设计能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般