1、选择题 下列离子方程式书写正确的是
A.将等体积等物质的量液度的NaHCO3溶液与Ba(OH)2溶液混合:

B.将碳与浓硫酸共热反应后的气体混合物通入过量氢氧化钠溶液中:
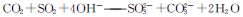
C.向次氯酸钙溶液中通入过量二氧化碳:
D.用Na2CO3溶液吸收Br2蒸气: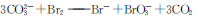
参考答案:A
本题解析:B、反应生成的CO2和SO2为1:2;
C、过量的CO2生成碳酸氢根;
D、质量不守恒,电荷不守恒;
本题难度:一般
2、填空题 25℃时,将0.01 mol 和0.002 mol
和0.002 mol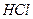 溶于水,形成1L混合溶液:
溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①?;
②?;
③?。
(2)溶液中共有七种不同的粒子(指分子和离子)。在这些粒子中,浓度为0.01 mol/L的是?,浓度为0.002 mol/L的是?;?和?两种粒子物质的量之和等于0.01 mol。
参考答案:(1)(每空2分)?①? H2O H+ + OH-;
H+ + OH-;
②? CH3COOH CH3COO- + H+;
CH3COO- + H+;
③? CH3COO- + H2O CH3COOH + OH-
CH3COOH + OH-
(2)(每空1分)? Na+ , Cl-;? CH3COO-和CH3COOH。
本题解析:略
本题难度:简单
3、选择题 下列离子方程式书写正确的是( )
A.铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑
B.氯化铝溶液中加入足量的氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+
C.氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+
D.碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O
参考答案:A、质量不守恒,正确的写法为:2Al+2H2O+2OH-═2AlO2-+3H2↑,故A错误;
B、氨水为弱碱,Al(OH)3不溶于弱碱,反应的离子方程 式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故B正确;
C、电荷不守恒,正确的写法为:2Fe3++Fe═3Fe2+,故C错误;
D、碳酸钙难溶于水,应写成化学式,故D错误.
故选B.
本题解析:
本题难度:简单
4、选择题 下列离子方程式中,书写正确的是(?)
A.铝与盐酸反应:Al + H+= Al3+ + H2↑
B.氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + OH- = AlO2- + 2H2O
C.铁与氯化铁溶液反应:Fe + Fe3+=2Fe2+
D.铝与氢氧化钠溶液反应:Al + 2 OH- = AlO2- + H2↑
参考答案:B
本题解析:A不正确,电子的得失不守恒;C不正确,电子的得失不守恒;D不正确,反应中中还有水参加,所以正确的答案选B。
点评:该题是高考中的高频题,属于中等难度的试题,试题侧重考查学生的能力。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,然后灵活运用即可。该题有助于培养学生分析问题、解决问题的能力。
本题难度:一般
5、选择题 下列离子方程式书写正确的是
A.金属钠溶于水:2Na+2H2O =2Na++2OH—+H2↑
B.氯化铝溶液与足量氨水反应:Al3++ 4OH-=AlO2-+2H2O
C.硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH?-=Cu(OH)2↓
D.铁与稀硫酸反应:2Fe +6H+=2Fe3++3H2↑
参考答案:A
本题解析:A 正确。遵循质量守恒、电荷守恒
B 错误,氨水是弱碱,写分子形式,且氢氧化铝也不溶于过量的氨水中
C 错误,同时生成硫酸钡沉淀
D 错误,铁与稀硫酸反应生成二价铁,不是三价铁。
本题难度:一般