1、选择题 原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
[? ]
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
参考答案:C
本题解析:
本题难度:一般
2、选择题 表明金属甲比金属乙活动性强的叙述是
A.氧化还原反应中,甲失电子数比乙多
B.同价态阳离子甲比乙氧化性强
C.甲能与浓硝酸反应放出气体而乙不能
D.将甲、乙与H2SO4溶液形成原电池,乙上冒气泡
参考答案:D
本题解析:金属的活动性体现失电子的能力,与失电子的数目无关;同价态阳离子的氧化性越强,对应金属的活动性越弱.
本题难度:困难
3、选择题 甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示。下列有关叙述正确的是? ( )。
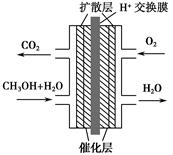
A.通氧气的一极为负极
B.H+从正极区通过交换膜移向负极区
C.通甲醇的一极的电极反应式为CH3OH+H2O-6e-=CO2↑+6H+
D.甲醇在正极发生反应,电子经过外电路流向负极
参考答案:C
本题解析:外电路中电子从负极流向正极,内电路H+从负极移向正极,B、D错误;O2在正极发生还原反应,A错误;甲醇在负极发生氧化反应,负极反应式为CH3OH+H2O-6e-=CO2↑+6H+。
本题难度:一般
4、实验题 (15分)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)(A) (B) 。
(2)如果(A或B)不能,说明其原因 。
(3)如果(A或B)可以,则写出正、负极材料及其电极反应式,电解质溶液
负极: ; 。
正极: ; 。
电解质溶液: 。
参考答案:(1)(A)不能(1分) (B)能 (1分)
(2)A反应是非氧化还原反应 (2分)
(3)负极:Cu(2分):Cu-2e-=Cu2+(2分)
正极:石墨(2分,其它合理答案亦可):2Fe3++2e-=2Fe2+(3分)
电解质溶液:氯化铁溶液(2分)
本题解析:(1)由于电子的定向运动形成电流,所以只有氧化还原反应才能设计成原电池,A是中和反应,表示氧化还原反应,不能设计成有点像。B是氧化还原反应,可以。
(3)根据B的总反应式可知,铜失去电子,作还原剂,所以作原电池的负极。正极材料只用金属性弱于铜即可。氯化铁得到电子,因此电解质溶液是氯化铁。
本题难度:一般
5、简答题 A、B、C三种强电解质,它们溶于水在水中电离出的阳离子有K+、Ag+,阴离子有NO3-、OH-(电解质电离的离子有重复).
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极.接通电源,经过一段时间后,测得甲中b电极质量增加了43.2g.常温下各烧杯中溶液pH与电解时间t关系如图2.请回答下列问题:

(1)写出三种强电解质的化学式:A______;B______;C______.
(2)写出乙烧杯c电极发生的电极反应为______,甲烧杯中的总反应的化学方程式为______.
(3)计算丙烧杯e电极上生成的气体在标准状况下的体积为______,甲烧杯中溶液体积为400ml,pH=______.
(4)要使甲烧杯中的A溶液恢复到电解前的状态,需要加入的物质是______,其质量为______.
(5)若直流电源使用的是铅蓄电池,铅蓄电池的正极材料是PbO2,负极材料是Pb,电解质溶液时H2SO4,则放电时N级上发生的电极反应为______,M级附近溶液的pH______(选填“升高”或“降低”或“不变”).铅蓄电池充电时,若阳极和阴极之间用阳离子交换膜(只允许H+通过)隔开,则当外电路通过0.2mol电子时,由阳极室通过阳离子交换膜进入阴极室的阳离子有______mol.
参考答案:A、B、C三种强电解质,它们溶于水在水中电离出的阳离子有K+、Ag+,阴离子有NO3-、OH-(电解质电离的离子有重复).
接通电源,经过一段时间后,测得甲中b电极质量增加了43.2克,说明b电极是阴极,连接b电极的电源电极为负极,即M为电源正极,N为电源负极;根据离子的放电顺序及图2可知,甲中pH减小,则A为AgNO3,乙中pH不变,则B为KNO3,丙中pH增大,且pH>7,则C为KOH,
(1)由上述分析可知,A为AgNO3,B为KNO3,C为KOH,故答案为:AgNO3;KNO3;KOH;
(2)c为阳极,氢氧根离子放电,则乙烧杯c电极发生的电极反应为4OH--4e-=O2↑+2H2O,甲中银离子和氢氧根离子放电,总反应为4AgNO3?电解?.?4Ag+O2↑+4HNO3,
故答案为:4OH--4e-=O2↑+2H2O;4AgNO3?电解?.?4Ag+O2↑+4HNO3;
(3)丙烧杯e电极上发生4OH--4e-=O2↑+2H2O,甲中b电极发生Ag++e-=Ag,由电子守恒可知4Ag~O2↑,n(Ag)=43.2g108g/mol=0.4mol,则n(O2)=0.1mol,其标况下的体积为0.1mol×22.4L/mol=2.24L,n(H+)=n(OH-)=0.4mol,则c(H+)=0.4mol0.4L=1mol/L,所以pH=0,故答案为:2.24L;0;?
(4)由甲中总反应为4AgNO3?电解?.?4Ag+O2↑+4HNO3,则由电子守恒可知应加入0.2molAg2O恢复原样,其质量为0.2mol×232g/mol=46.4g,
故答案为:Ag2O;46.4g;
(5)铅蓄电池的正极材料是PbO2,负极材料是Pb,电解质溶液时H2SO4,放电Pb为负极,负极(N极)反应为Pb-2e-+SO42-=PbSO4,正极(M极)反应为PbO2+2e-+SO42-+4H+=PbSO4+2H2O,显然氢离子浓度减小,pH升高,充电时,2H+~2e-,当外电路通过0.2mol电子时,由阳极室通过阳离子交换膜进入阴极室的阳离子有0.2mol,
故答案为:Pb-2e-+SO42-=PbSO4;升高;0.2.
本题解析:
本题难度:一般