1、实验题 (6分)有一瓶澄清溶液,可能含有NH+4、K+、Mg2+、Ba2+、Al3+、Fe3+、SO2
2、填空题 (12分)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为 。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为 ;该工艺选择氯气的优点是 。(答一点即可)
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3 mol,则理论上生成的SO42-为 mol。
(4)生产和实验中广泛采用甲醛法测定样品的含氮量。甲醛和铵根离子的反应如下:
4NH4+ + 6HCHO =(CH2)6N4H+(一元酸)+ 3H+ + 6H2O
实验步骤如下:
①已知甲醛溶液中常含有甲酸。取b mL甲醛溶液(过量)于锥形瓶,加入1滴酚酞,用浓度为c mol/L的NaOH溶液中和,滴定管的初始读数V1 mL,当溶液呈微红色时,滴定管的读数V2 mL。
②向其中加入饱和食盐水试样a mL,静置数分钟。
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3 mL。
则饱和食盐水中的含氮量为 mg/L。
3、填空题 某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为?,浓度是?mol·L-1。
由②可知存在的离子为?,浓度是?mol·L-1。
由③可知存在的离子为?,浓度是?mol·L-1。
(2)该溶液中一定不存在的离子是?(填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是?。
4、选择题 常温下,下列各组离子在指定溶液中能大量共存的是
[? ]
A.滴加石蕊试液显红色的溶液:Al3+、Fe2+、ClO-、SO42-
B.含有0.1 mol/LFe3+的溶液:K+、Mg2+、S2-、NO3-
C.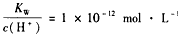 的溶液:K+、Fe3+、SO42-、NO3-
的溶液:K+、Fe3+、SO42-、NO3-
D.水电离的c(H+)=10-12 mol/L的溶液:Mg2+、NH4+、HCO3-、Cl-
5、选择题 下列各组离子在水溶液中能大量共存的是
A.Na+、Ba2+、Cl-、SO42-
B.Ca2+、HCO3-、C1-、K+
C.Mg2+、Ag+、NO3-、Cl-
D.H+、Cl-、Na+、CO32-