1、简答题 (1)已知某反应的各物质浓度数据如下:aA(g)+bB(g)

2C(g)
起始浓度(mol/L):1.5?1.0?0
2s末浓度(mol/L):0.9?0.8?0.4
则①a=______,b______.
②2S内B的反应速率=______.
(2)由碳棒,铁片和200mL?1.5mol/L的稀硫酸组成的原电______池中,当在碳棒上产生气体3.36L(标准状况)时,求
③有______个电子通过了电线?(NA=6.02×1023)
④此时溶液中H+的物质的量浓度为______(不考虑溶液体积变化).
(3)将2.3g金属钠放入足量的m?g重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是______(用含m的代数式表示)
2、简答题 自然界的矿物、岩石的成因和变化受到许多条件的影响.地壳内每加深1km,压强增大约25000~30000kPa.在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g)

SiF4(g)+2H2O(g)+148.9kJ
根据题意完成下列填空:
(1)在地壳深处容易有______气体逸出,在地壳浅处容易有______沉积.
(2)如果上述反应的平衡常数K值变大,该反应______(选填编号).
a.一定向正反应方向移动?b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动?d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______(选填编号).
a.2v正(HF)=v逆(H2O)?b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变?d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为______.
3、填空题 大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(g)=HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq)=I2(aq)+H2O(l)ΔH3
总反应的化学方程式为_________________________________,
其反应热ΔH=______________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)  I3-(aq),其平衡常数表达式为________。
I3-(aq),其平衡常数表达式为________。
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表。
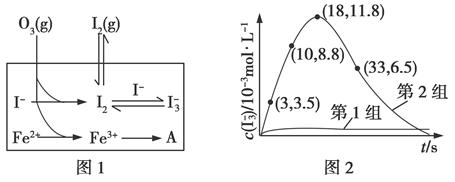
编号
| 反应物
| 反应前pH
| 反应前pH
|
第1组
| O3+I-
| 5.2
| 11.0
|
第2组
| O3+I-+Fe2+
| 5.2
| 4.1
|
?
①第1组实验中,导致反应后pH升高的原因是______________。
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是____________________。
③第2组实验进行18 s后,I3-浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小
B.c(I-)减小
C.I2(g)不断生成
D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
4、选择题 某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )
A.0.04
B.0.04mol/(L.s)
C.0.08mol/(L.s)
D.0.04mol/L
5、选择题 20 ℃ 时,将0.1 mol/L Na2S2O3溶液10mL 和 0.1 mol/L H2SO4溶液10mL混合,2 min 后溶液出现明显浑浊(发生的反应为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O)。已知温度每升高10 ℃ ,该反应的化学反应速率增大到原来的2倍。那么50 ℃时,同样的反应要明显地出现浑浊,所需时间是
A.48s
B.40s
C.20s
D.15s