1、选择题 下列符合化学实验“绿色化学”的有( )
①用铜制取硝酸铜先把铜加热制氧化铜再和稀硝酸反应
②在铜与浓硫酸反应的实验中,将铜片改为可调节高度的铜丝
③将实验室中的废酸液和废碱液中和后再排放.
A.①②
B.①③
C.②③
D.①②③
2、选择题 在我国干旱严重的华北地区,近年来利用飞机、高炮或火箭等运载工具向过冷云层中播撒碘化银或干冰,实现人工增雨,达到减灾的目的。下列有关人工增雨的评述中,你认为不太合理的是(?)
A.它对农业生产和大气环境的改善有一定的效益
B.它使用的碘化银中的重金属元素将对地表土壤造成污染
C.它使用的碘化银如换成干冰,可避免重金属元素对土壤的污染
D.它是人类彻底战胜自然的表现,体现了人类的力量是无穷的
3、实验题 (13分)工业合成氨与制备硝酸一般可连续生产,流程如下:
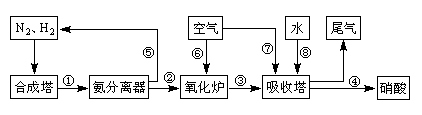
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g)?△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
2NH3(g)?△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
T/℃
| T1
| 300
| T2
|
K
| 1.00×107
| 2.45×105
| 1.88×103
|
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示。温度高于900℃时,NH3产率下降的原因?。

(4)在上述流程图中,氧化炉中发生反应的化学方程式为___________。
(5)硝酸厂的尾气直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g) +2H2O(g)?△H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式____________________,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是__________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为_______________________。
4、计算题 “毒鼠强”是一种灭鼠药,具有极强的毒性,国家已禁止使用。它是一种含有C、H、O、N、S的有机物,其摩尔质量为240 g/mol ;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.3%,所含氧 元素的质量分数为26.7%,其余为N、S。
元素的质量分数为26.7%,其余为N、S。
⑴误食0.1 g“毒鼠强”就可以使人死亡,0.1g“毒鼠强”的物质的量为多少?
⑵试求0.1 g “毒鼠强”中C、H、O三种元素的原子个数比(取整数值)。
5、选择题 工业生产乙烯的原料主要是
A.天然气
B.煤
C.石油
D.酒精