1、实验题 (12分)某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体?g。
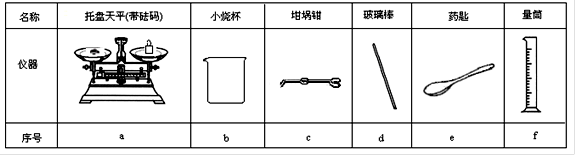
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):?。
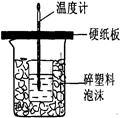
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如右图所示。
Ⅱ.中和热的测定:
(3)从实验过程来看,图中尚缺少的两种玻璃仪器是? __、________;
(4)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
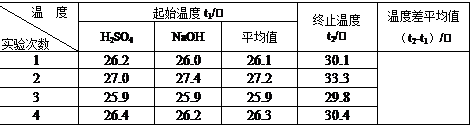
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c =" 4.18" J/(g·℃)。则中和热△H= ?(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)?。
a.实验装置保温、隔热效果差
b.配制0.50 mol/L NaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数
(5)实验中改用30 mL 0.50 mol/L的硫酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量?(填“相等”或“不相等”),所求中和热的数值会?__________(填“相等”或“不相等”)。
参考答案:(共12分)(1)5.0?(1分)?
(2)a b e(少选或多选均记零分、1分)
(3)量筒和环形玻璃棒(各1分,共2分);(4)① 4.0(2分)②? -53.5 kJ/mol (没“-”号或没单位均不给分、2分)
③ a c d(少选、错选均不给分、2分)
(5)不相等、相等;(每空1分,共2分)
本题解析:(1)由于容量瓶的规格没有245ml的,所以应该配制250ml,因此需要氢氧化钠的质量是0.5mol/L×0.25L×40g/mol=5.0g。
(2)氢氧化钠固体称量,需要托盘天平,烧杯和钥匙,因此正确答案选abe。
(3)考查中和热的测定及误差分析等。在实验过程中,为使溶液混合均匀,需要搅拌,因此还缺少的仪器是环形玻璃搅拌棒。
(4)①根据表中数据可知,温度的差值是(℃)4.0、6.1、3.9、4.1,所以根据表中数据实验2的误差太大,舍去。因此温度差的平均值是(4.0+3.9+4.1)℃÷3=4.0℃。
②反应中生成0.025mol水,所以反应热△H=-0.00418×4.0×80÷0.025=-53.5 kJ/mol。
③53.5 kJ/mol小于57.3 kJ/mol,选项a有热量损失,测定结果偏小;配制0.50 mol/L NaOH溶液时俯视刻度线读数时,浓度偏大,测定结果偏高;次数越多,热量损失越多;用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,则温度差值减小,测定结果偏小;用量筒量取NaOH溶液的体积时仰视读数,则氢氧化钠的体积增加,测定结果偏高,实验答案选acd。
(5)改变酸或碱的用量,反应放出的热量改变,但中和热是不变的,因为中和热于酸或碱的用量无关系。
本题难度:一般
2、填空题 A:下面所列的是中学化学实验室中几种常见的玻璃仪器:
①温度计、?②容量瓶、③滴定管、④烧杯、⑤蒸馏烧瓶、
⑥ 量筒、?⑦玻璃棒、⑧蒸发皿
量筒、?⑦玻璃棒、⑧蒸发皿
在仪器上具体标明使用温度的是(不考虑温度计) (填编号);
标有“0”刻度的有 ?(填编号)
对允许加热的仪器,加热时必须垫上石棉网的有 (填编号);
使用时必须检查是否漏水的有 (填序号);
B:现用物质的量的浓度为a mol / L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是?;
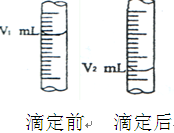
②右图是酸式滴定管中液面在滴定前后的读数:则c (NaOH)= ?;
C:拟在烧杯中于加热条件下配置某溶液50mL,应选择的烧杯是(用字母回答)
A.400mL
B.250mL
C.100mL
D.50 ml