1、选择题 下列热化学方程式数学正确的是(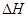 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g);△H=-269.8kJ/mol(反应热)
D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
参考答案:D
本题解析:A错,燃烧热是指常温常压下,1mol纯物质完全燃烧生成稳定的氧化物所放出的能量,正确为:C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(l);△H=-1367.0 kJ/mol(燃烧热);B错,正确为:NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H= —57.3kJ/mol(中和热);
C错,正确为:S(s)+O2(g)===SO2(g);△H=-269.8kJ/mol(燃烧热);D正确;
本题难度:一般
2、选择题 下列过程中,把化学能转化为热能的是(?)
A.风力发电
B.干电池产生电流
C.木炭燃烧
D.用电取暖器取暖
参考答案:C
本题解析:略
本题难度:简单
3、选择题 下列有关能量转换的说法正确的是
[? ]
A.煤燃烧是化学能转化为光能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列物质有漂白性的是
A.SO2水溶液
B.液氯
C.SO2与Cl2等摩尔混合后配成溶液
D.久置氯水
参考答案:A
本题解析:分析:HClO具有强氧化性,能使有色物质褪色,而SO2与有色物质化合生成无色物质,使有色物质褪色,以此来解答.
解答:A.SO2水溶液中,SO2与有色物质化合生成无色物质,使有色物质褪色,具有漂白性,故A选;
B.液氯为单质,本身不具有漂白性,与水反应生成的HClO具有漂白性,故B不选;
C.SO2与Cl2等摩尔混合后配成溶液中为硫酸和盐酸的混合溶液,不具有漂白性,故C不选;
D.久置氯水中HClO分解,最终为盐酸溶液,不具有漂白性,故D不选;
故选A.
点评:本题考查二氧化硫的性质,注意其漂白原理是利用化合反应生成无色物质,属于暂时性的漂白,题目难度不大.
本题难度:一般
5、填空题 已知A(g)+B(g)═C(g)+D(g)反应过程中的能量变化如图所示,回答下列问题.
(1)该反应是______反应(填“吸热”、“放热”).当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),
(2)在反应体系中加入催化剂,反应速率增大,E的变化是______,(填“增大”、“减小”或“不变”)理由是______E的大小对该反应的反应热有无影响?______.
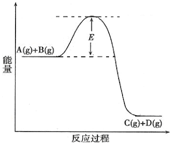
参考答案:(1)由图象可知该反应是一个能量降低的反应,所以属于放热反应;对应放热反应,升高温度,平衡逆移,A的浓度增大,A的转化率减小;
故答案为:放热;减小;
(2)加入催化剂改变了反应的途径,降低反应所需的活化能,所以E的变化是减小,催化剂不改变反应物总能量与生成物总能量之差即反应热不变,所以E的大小对该反应的反应热无影响;
故答案为:减小;催化剂改变了反应的途径,降低了反应所需的活化能;无影响.
本题解析:
本题难度:一般