1、填空题 (16分)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产?的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是?(填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
?。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g)?△H=?。
2SO3(g)?△H=?。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下:

①求该温度时,氨水的电离平衡常数K=?。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
①? a ??b?(填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)=?。
(用含有a、b的式子表示)
参考答案:(16分,每空2分)
I.(1)硫酸 (或者H2SO4)?
(2)a d
(3)①在常压下,此反应的转化率已经达到96%,没有必要再增大压强了。
②-396.00 kJ/mo1
Ⅱ.(1)① 4.00×10-4
②
(2)① <? ② 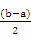
本题解析:I.(1)二氧化硫的催化氧化是工业生产硫酸的重要步骤;
(2)a、每生成1mol SO3的同时生成0.5mol O2,代表正逆两个反应方向且符合化学方程式中的系数比,符合正逆反应速率相等,达到平衡状态,正确;b、恒容条件下,气体的质量不变,所以气体的密度一直不变,不能判断是否达平衡状态,错误;c、体系中各物质的物质的量之比等于化学计量数之比时不一定达平衡状态,错误;d、该反应的特点是反应前后的气体的物质的量发生改变,所以恒容时气体的压强在变,达平衡时,气体压强不再变化,正确,答案选ac。
(3)①常压下,平衡时二氧化硫的转化率是96%,已经很高,所以没有必要再增大压强了;
②二氧化硫转化96%放出190.08KJ的热量,所以1mol二氧化硫气体完全反应则放出190.08kJ÷96%=198.00kJ的热量,所以该反应的热化学方程式中二氧化硫的系数是2,代表2mol的二氧化硫完全反应,放出的热量是198.00kJ×2=396.00kJ,所以△H=-396.00 kJ/mo1;
II.(1)①根据题意可知氨水的浓度是1mol/L, c(NH4+)= c(OH-)=0.02mol/L,所以氨水的电离常数K= c(NH4+)· c(OH-)/c(NH3·H2O)= 0.022mol/L/1mol/L= 4.00×10-4
②氨水稀释会促进一水合氨的电离,体积变为原来的2倍,则氢氧根离子浓度减小为原来的一半,根据勒夏特列原理,最终氢氧根离子、铵根离子的浓度仍会减小,所以图像的起点在0.01处,最大值在原图像的下方,如图 ;
;
(2)①若a=b,则二者恰好完全反应,溶液呈酸性,现在溶液呈中性,说明氨水过量,所以a<b;
②设二者的体积均是1L,因为b>a,则剩余氨水的物质的量是b-a,体积扩大到原来的2倍,所以剩余氨水浓度:c(NH3·H2O)=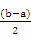 。
。
本题难度:一般
2、选择题 下列说法正确的是( ▲ )
A.任何化学反应都伴随着能量的变化
B.1 mol H2SO4和 1 mol Ba(OH)2完全反应所放出的热量称为中和热
C.在101kPa 时,1 mol 碳燃烧放出的热量就是碳的燃烧热
D.在化学反应中需要加热的反应就是吸热反应
参考答案:A
本题解析:略
本题难度:一般
3、选择题 下列关于能量变化的说法中错误的是
A.反应物的总能量高于生成物的总能量时,发生放热反应
B.燃煤发电是直接把化学能转化为电能
C.需要加热才能进行的化学反应不一定是吸热反应
D.化学反应过程中的能量变化,服从能量守恒定律
参考答案:B
本题解析:燃煤发电是先把化学能转化为热能,热能再转化为动能,然后在带动机器发电,所以选项B不正确,其余选项都是正确的,答案选B。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题贴近生活实际,有利于调动学生的学习兴趣和学习积极性,侧重对学生基础知识的巩固和训练。
本题难度:简单
4、选择题 下列说法正确的是(?)?
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量。
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据。
C.书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态。
D.凡是化合反应都是放热反应,分解反应都是吸热反应。
参考答案:C
本题解析:书写和应用热化学方程式时必须注意以下几点:
(1)反应热与温度和压强等测定条件有关,所以书写时指明反应时的温度和压强(25℃、101kPa时,可以不注明)
(2)各物质化学式右侧用圆括弧()表明物质的聚集状态。可以用g、l、s分别代表气态、液态、固态。
(3)热化学方程式中化学计量数只表示该物质的物质的量,不表示物质分子个数或原子个数,因此,它可以是整数,也可以是分数。
(4)热化学方程式是表示反应已完成的数量。由于△H与反应完成物质的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
化合反应不一定都是放热反应,分解反应不一定都是吸热反应。
点评:理解热化学方程式的书写(各物质化学式右侧用圆括弧()表明物质的聚集状态)、含义(热化学方程式中化学计量数只表示该物质的物质的量)。
本题难度:一般
5、选择题 强酸和强碱稀溶液的中和热可表示为
H+(aq)+OH-(aq) H2O(l);ΔH="-57.3" kJ·mol-1
H2O(l);ΔH="-57.3" kJ·mol-1
已知:
①HCl(aq)+NH3·H2O(aq) NH4Cl(aq)+H2O(l);ΔH="-a" kJ·mol-1
NH4Cl(aq)+H2O(l);ΔH="-a" kJ·mol-1
②HCl(aq)+NaOH(s) NaCl(aq)+H2O(l);ΔH="-b" kJ·mol-1
NaCl(aq)+H2O(l);ΔH="-b" kJ·mol-1
③HNO3(aq)+KOH(aq) KNO3(aq)+H2O(l);ΔH="-c" kJ·mol-1
KNO3(aq)+H2O(l);ΔH="-c" kJ·mol-1
则a、b、c三者的大小关系为(?)
A.a>b>c
B.b>c>a
C.a="b=c"
D.无法比较
参考答案:B
本题解析:考查的是中和热,但因NH3·H2O的电离是吸热的,NaOH(s)溶解是放热的,从而使①中的中和热小于57.3 kJ·mol-1,②中的中和热大于57.3 kJ·mol-1,所以B正确。学生往往只注意到中和热的本质,生成1 mol H2O(l),而忽视其他变化过程中的热效应,而错选C。在教学中应加强从能量、得失电子、离子反应等多角度对化学反应的分析理解,这是教学的忽视点,应引起重视。
本题难度:一般