1、实验题 K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:
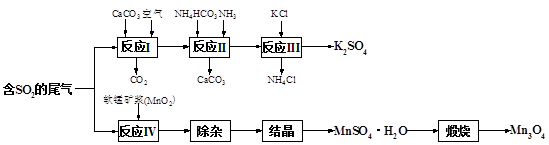 ?
?
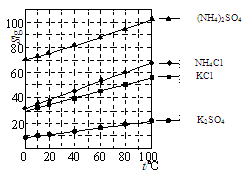
(1)几种盐的溶解度见图。反应III中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、?、洗涤、干燥等操作即得K2SO4产品。
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是:?。
(3)反应IV的化学方程式为??。
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为??。
(5)下图是煅烧MnSO4?H2O时温度与剩余固体质量变化曲线。
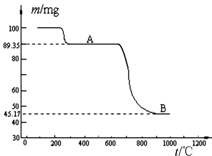
①该曲线中B段所表示物质的化学式为?。
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因:?。
参考答案:
(1)趁热过滤
(2)取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液
(3)MnO2+SO2=MnSO4
(4)Mn3O4+8H++2Cl- 3Mn2++Cl2↑+4H2O
3Mn2++Cl2↑+4H2O
(5)①Mn3O4②部分Mn3O4又被氧化为Mn2O3或MnO2,造成总锰含量减小
本题解析:(1)四种物质中相同温度下硫酸钾溶解度最小,所以反应III中蒸发浓缩后硫酸钾析出,趁热过滤得硫酸钾晶体,再洗涤、干燥即可。(2)检验Cl-一般用硝酸银溶液和稀硝酸,但SO42-也能与Ag+形成硫酸银沉淀,所以检验Cl-前要先加过量硝酸钡溶液将SO42-沉淀,过滤后向滤液中加硝酸银溶液看是否产生白色沉淀。(3)二氧化锰与二氧化硫生成硫酸锰。(4)Mn常见价态有+2、+4、+6、+7,四氧化三锰可改写为MnO2·2MnO,MnO2与浓盐酸生成MnCl2、Cl2和H2O、MnO与盐酸生成MnCl2和H2O。(5)由流程图可知硫酸锰晶体锻烧得到四氧化三锰,根据图中数据,由Mn守恒确认B为四氧化三锰。温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小原因可能是四氧化三锰被氧化为二氧化锰或三氧化二锰,使锰含量减小。
本题难度:困难
2、选择题 锅炉燃煤采用沸腾炉用鼓风机将煤粉吹起成沸腾状况燃烧,用沸腾炉的好处(?)?
A.增大煤炭燃烧时放出的热量
B.使得燃料燃烧充分,从而提高燃料的利用率
C.增大煤炭与氧气的接触几率,形成清洁能源
D.减少炉中杂质气体(如SO2等)的形成
参考答案:B
本题解析:A中燃烧产物不变,不能增大煤炭燃烧时放出的热量,故A错误;B中锅炉燃煤时用鼓风机将煤粉吹起,成沸腾状燃烧,这样能使煤燃烧充分,从而提高燃料的利用率,故B正确;C中能增大煤炭与氧气的接触面积,不会改变生成产物,所以不能使煤变成清洁能源,故C错误;D中反应物不变,燃烧过程不变,不能减少有害杂质气体(如SO2等)的形成,故D错误,答案选B。
点评:该题是高考中的常见题型,属于基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的环境保护意识和能源节约意识。
本题难度:简单
3、填空题 (1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”(侯氏制碱法)两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:_________________________________________________;
②写出“联合制碱法”有关反应的化学方程式_________________?_;?。
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?________________________________________;
(2)钢铁工业对促进经济和社会发展起了重要作用。
①炼钢时,加入硅、锰和铝的目的是_______________________________。
②不锈钢含有的Cr元素是在炼钢过程的氧吹__?__(填“前”或“后”)加入。
③炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_________。
参考答案:(1)①2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O?(2分)
2NH3↑+CaCl2+2H2O?(2分)
②NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl?(2分)
2NaHCO3 Na2CO3+CO2↑+H2O?(2分)
Na2CO3+CO2↑+H2O?(2分)
(或写总反应方程式:2NaCl+2NH3+CO2+H2O=Na2CO3+2NH4Cl)
③“氨碱法”CO2来源于石灰石煅烧,“联合制碱法”CO2来源于合成氨工业的废气;(2分)
(2)①脱氧和调整钢的成分?(2分)
②后 (1分)
③CO (2分)?燃料(或还原剂)?(2分)
本题解析:(1)?①氨碱法中为回收氨而使石灰乳与副产物氯化铵反应,从而产生大量CaCl2废渣。2NH4Cl + Ca(OH)2=CaCl2+2H2O+2NH3↑;②联合制碱法的主要化学反应为:
NaCl(饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl? 2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
③氨碱法的CO2来源于石灰石的煅烧,“联合制碱法”的CO2来源于合成氨工业的废气;
(2)①炼钢时,加入硅、锰和铝主要是可以脱氧和调整钢的成分;②?因为Cr易被氧化,为防止Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去;③炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行处理。
本题难度:一般
4、填空题 利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
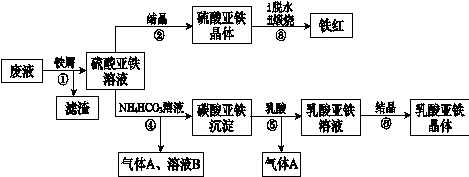
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是???。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、????。
(1)步骤④的离子方程式是?。
(1)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及???。
(1)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为???。
(1)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因?。
(1)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol?L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)?。
参考答案:
(1)玻璃棒、烧杯、漏斗?(1分) ;冷却结晶、过滤、洗涤、干燥(1分)
(1)Fe2++2HCO3-=FeCO3↓+H2O+CO2↑(2分)?
(1)防止Fe2+被氧化(1分)?
(1)1: 4?(2分) ?
(1)FeCO3(s)  ?Fe2+(aq)+ CO32-(aq)? CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液(2分)?
?Fe2+(aq)+ CO32-(aq)? CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液(2分)?
(1)13.9/a ×100%(2分)
本题解析:
(1)过滤用的仪器:玻璃棒、烧杯、漏斗?;“冷却结晶、过滤、洗涤、干燥”从溶液变成纯固体。
“冷却结晶、过滤、洗涤、干燥”从溶液变成纯固体。
(2)Fe2++2HCO3-→FeCO3↓+H2O+CO2↑?
(3)隔绝空气,防止Fe2+被氧化 。?
(4)4FeSO4+ O2 =4SO3? + 2 Fe2O3?氧化剂O2和还原剂FeSO4的物质的量之比? 1: 4?。?
(6)FeSO4和KMnO4反应的关系式 解:设20.00 mL溶液含FeSO4的物质的量为x
10FeSO4·7H2O ——2 KMnO4
2
x?0.1000*20.00/1000? x=0.01
100 mL FeSO4·7H2O的物质的量为0.01*5=0.05 (mol)
FeSO4·7H2O的质量分数为278*0.05*100%/a=13.9/a ×100%
本题难度:困难
5、选择题 家庭住宅的窗玻璃大部分是普通玻璃,其成分是Na2SiO3?CaSiO3?6SiO2,在生产过程中加入不同的物质,调整玻璃的化学成分,可以制得具有不同性能和用途的玻璃.下表所列不正确的是( )
| 选项 | A | B | C | D
添加成分
Co2O3(氧化钴)
Cu2O
Fe2+
PbO
玻璃的色彩或性能
蓝色
红色
钢化玻璃
光学玻璃
|