1、选择题 下列有关反应的离子方程式不正确的是
A.向Ba(OH)2溶液中加入少量NaHSO3溶液:HSO3-+Ba2++OH-═BaSO3↓+H2O
B.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+2H2O?H2CO3+2OH-
C.足量的铁溶于少量的稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O
D.向AgCl悬浊液中加入KI溶液振荡,出现黄色沉淀:AgCl(S)+I-?AgI(S)+Cl-
参考答案:B
本题解析:分析:A、碱和酸式盐反应,量少的全部反应,离子方程式中符合化学式的组成比;
B、碳酸钠溶液中碳酸根离子是多元弱酸阴离子,分步水解呈碱性;
C、足量铁反应生成亚铁离子,依据电荷守恒和原子守恒判断;
D、碘化银的溶解度小于氯化银.可以实现沉淀转化;
解答:A、向Ba(OH)2溶液中加入少量NaHSO3溶液:HSO3-+Ba2++OH-═BaSO3↓+H2O,故A正确;
B、向Na2CO3溶液中滴入酚酞溶液,溶液变红,碳酸根离子是多元弱酸阴离子,分步水解呈碱性:CO32-+H2O?HCO3-+OH-;HCO3-+H2O?H2CO3+OH-;故B错误;
C、足量的铁溶于少量的稀硝酸,反应的离子方程式:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故C正确;
D、向AgCl悬浊液中加入KI溶液振荡,出现黄色沉淀,碘化银溶解度小于氯化银,实现沉淀转化,反应的离子方程式:AgCl(S)+I-?AgI(S)+Cl-,故D正确;
故选B.
点评:本题考查了离子方程式的书写方法和注意问题,注意酸式盐和碱反应量不同产物不同,沉淀转化判断,氧化还原反应的产物判断,题目难度中等.
本题难度:简单
2、填空题 水是生命之源,水处理工艺在生产生活中占有重要地位。自来水生产的流程示意图如下。(净水剂亦称混凝剂,常用的净水剂有聚合氯化铝、碱式氯化铝、硫酸亚铁、聚丙烯酰胺、聚合氯化铝铁、三氯化铁、聚合硫酸铁等)
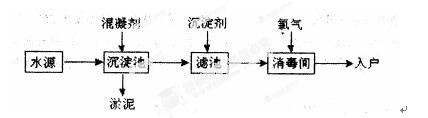
(1)FeSO4·7H2O是常用的混凝剂,它在水中最终生成?沉淀。
(2)[A12(OH)nClm]是一种无机高分子的高价聚合电解质混凝剂,可视为介于三氯化铝和氢氧化铝之间的一种中间水解产物,则m与n之间的关系??;
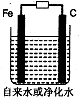
(3)推销净水器的商人用自来水做电解实验,装置如图。一段时间后,两极间产生白色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验;两极上只有气体产生,水中并无沉淀,以此来说明自来水很“脏”。则沉淀变成红褐色时所发生的化学反应方程式为:?。
(4)MnSO4是水质检测中的一种常用试剂
①MnSO4和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸盐及另外一种产物,写出并配平上述反应的化学方程式:?。?
②水中的溶解氧测定过程为:取水样,迅速加入MnSO4和KOH混合液,再加入KI溶液,立即塞好塞子,振荡使完全反应(反应为:Mn2++O2+H2O→MnOOH,未配平)。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。则该离子反应方程式:?。用Na2S2O3溶液滴定生成的碘,根据消耗溶液的体积可计算出水中溶解氧的量。
参考答案:
(1)Fe(OH)3?
(2)m+n=6
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)①2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4,(Ag+催化剂)
②6H++2MnOOH+2I-=I2+2Mn2++4H2O
本题解析:
(1)FeSO4·7H2O溶于水,水解之后生成Fe(OH)2,继续被氧化成Fe(OH)3胶体,Fe(OH)3胶体有很强的吸附能力,将水中的悬浮颗粒物吸附并沉降下来,所以最终生成Fe(OH)3沉淀。
(2)由[A12(OH)nClm],根据化合价整体为0,因此m+n=6。
(3)铁在阳极放电,电极反应为:Fe-2e-=Fe2+,之后Fe2+ + 2OH- =Fe(OH)2↓,Fe(OH)2易被氧化,4Fe(OH)2?+O2+2H2O=4Fe(OH)3↓白色沉淀变成红褐色。
(4)①陌生情景下氧化还原反应方程式的书写步骤是:先写骨架(氧化剂、还原剂、氧化产物、还原产物),再根据电子守恒把骨架配平,最后根据原子守恒在方程式的两边在“H2O”上做文章。根据题意,硫酸锰被氧化成高锰酸钾,则过硫酸钾被还原成硫酸盐(硫酸钾),所以骨架为硫酸锰、过硫酸钾、高锰酸钾、硫酸钾,根据电子守恒把骨架配平,再根据原子守恒,方程式的左边有12个硫原子,右边只有4个硫原子,所以右边还缺8个硫原子,同时化合价应该是+6价,而钾原子已经守恒,所以只能是硫酸,如果在右边添加8H2SO4 ,再根据氢原子或者氧原子守恒,在方程式的左边补充“8H2O”。 ②取水样,迅速加入MnSO4和KOH混合液,再加入KI溶液,发生题干中的反应,即Mn2+被氧化成MnOOH,加入硫酸后,I-在酸性条件下被MnOOH氧化成I2,这也是一个氧化还原反应,书写思路同上,先写骨架并配平,再根据电荷守恒和原子守恒,在左边补充H+,在右边补充“H2O”即可。
本题难度:一般
3、选择题 下列电离方程式中,正确的是
A.H2SO4=H2++SO42-
B.Ba(OH)2=Ba2++OH-
C.NaNO3=Na++NO3-
D.HClO=H++Cl-+O2-
参考答案:C
本题解析:A.H2SO4=2H++SO42-;B.Ba(OH)2=Ba2++2OH-; C.正确;D.HClO=H++ClO-;选C。
本题难度:困难
4、选择题 下列各组离子中,每个离子都能影响水的电离平衡的一组是 ( )
A.Zn2+、Ag+、HCO3-、Cl-、PO43-、SO42-
B.Fe3+、Br-、Al3+、H+、CO32-、H2PO4-
C.Ag+、SO32-、SiO32-、Fe2+、S2-
D.Fe2+、ClO-、OH-、HS-、Cu2+、HSO3-
参考答案:CD
本题解析:试题分析:在溶液中盐电离出的离子与水电离出的氢离子或氢氧根结合生成弱电解质的反应,称为盐类水解,这说明有弱才能发生水解反应,所以A中的Cl-、SO42-,B中的Br-、H+都不能水解,答案选CD。
考点:考查盐类水解的判断
点评:该题是基础性试题的考查,试题难易适中,注重基础知识的巩固,该题的关键是明确盐类水解的条件,然后灵活运用即可得出正确的结论。
本题难度:困难
5、选择题 向10mL 0.1mol·L?1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+)
B.x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-)
C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-) = c(Ba2+)
参考答案:A
本题解析:NH4Al(SO4)2溶液中滴加Ba(OH)2溶液,Ba2+与SO42-形成沉淀, OH-与NH4+、Al3+、Al(OH)3反应的顺序为:先Al3++3OH-=Al(OH)3↓、后NH4++OH-=NH3·H2O、最后Al(OH)3+OH-=AlO2-+2H2O。
当加入氢氧化钡溶液10mL时,Ba2+与SO42-反应时,SO42-过量;3OH-+Al3+=Al(OH)3↓反应后Al3+过量,NH4+不反应,所以溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+),A正确、B错误;
当加入氢氧化钡溶液30mL时,Ba2+与SO42-反应时Ba2+过量,Al3++3OH-=Al(OH)3↓,反应后剩余OH-3mmol,接下来发生NH4++OH-=NH3·H2O,又剩余OH-2mmol,最后OH-溶解Al(OH)3后又剩余OH-1mmol,生成AlO2-1mmol,考虑AlO2-水解,c(OH-)>c(AlO2-),C、D错误。
点评:有关反应进程的问题要搞清楚反应进行的先后顺序。
本题难度:一般