1、选择题 下列方法能直接从海水中制取可用水的是( )
A.萃取
B.蒸馏
C.结晶
D.过滤
参考答案:A.萃取是利用溶解性的差异来分离相互溶解的液体,故A不选;
B.蒸馏是利用沸点不同来分离混合物的方法,则蒸馏可直接从海水中制取可用水,故B选;
C.结晶是利用均易溶于水的物质的溶解度受温度影响的差异来分离混合物的方法,故C不选;
D.过滤是分离不溶物质与可溶性物质的方法,故D不选;
故选B.
本题解析:
本题难度:简单
2、选择题 除去硬脂酸钠中混有的甘油,可采用的方法是
[? ]
A.加水后分液
B.加烧碱溶液后分液
C.加醋酸后分液
D.加食盐固体后搅拌
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列除去杂质的操作中,不能达到目的是( )
A.除去苯中的少量溴:加入CCl4萃取后分液
B.除去乙烷中的乙烯:通入溴水中
C.除去CO2中的少量HCl气体:通过盛有饱和NaHCO3溶液的洗气瓶
D.除去FeCl2溶液中的少量FeCl3:加入足量Fe粉后过滤
参考答案:A.溴易溶于苯和四氯化碳,则除去除去苯中的少量溴,不能加入CCl4萃取后分液,应加NaOH溶液反应后分液,故A错误;
B.乙烯与溴水反应,而乙烷不反应,且不引入新杂质,则除去乙烷中的乙烯可通入溴水中,故B正确;
C.HCl与NaHCO3溶液生成二氧化碳,则除去CO2中的少量HCl气体可通过盛有饱和NaHCO3溶液的洗气瓶,故C正确;
D.氯化铁与铁反应生成氯化亚铁,则除去FeCl2溶液中的少量FeCl3可加入足量Fe粉后过滤,故D正确;
故选A.
本题解析:
本题难度:一般
4、选择题 检验某溶液中是否含有SO42-离子,常用的方法是(? )?
A.取样,滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
B.取样,滴加稀盐酸酸化的BaCl2溶液,看是否有不溶于水的白色沉淀生成
C.取样,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
D.取样,滴加稀硫酸,再滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
参考答案:C
本题解析:考查SO42-离子的检验。检验SO42-离子时,需要首先加入稀盐酸以排斥其他离子的干扰,然后再加入氯化钡溶液即可,所以正确的答案选C。
本题难度:一般
5、填空题 (15分)锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害。对废旧电池进行资源化处理显得非常重要。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
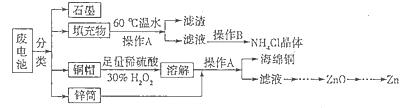
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为_________________________________________________________。
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是___________。
(3)操作A的名称为_____________ 。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有___________mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:________________。
(5)铜帽溶解时加入H2O2的目的是_______________________________(用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
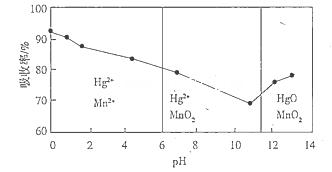
根据上图可知:
①pH对Hg吸收率的影响规律是__________________________________________________.
②在强酸性环境下Hg的吸收率高的原因可能是_____________________________________.
参考答案:(1)Zn+2OH--2e-=Zn(OH)2?(2)温度过高氯化铵受热分解?(3)过滤
(4)①4?②2MnO(OH)+6HCl(浓)  2MnCl2+Cl2↑+4H2O?
2MnCl2+Cl2↑+4H2O?
(5)Cu+H2O2+H2SO4=CuSO4+2H2O?加热?
(6)①随pH升高,汞的吸收率先降低后增加?② KMnO4在酸性条件下氧化性强
本题解析:(1)根据已知条件可知该电池中的负极的电极式是Zn+2OH--2e-=Zn(OH)2。(2)为加快溶解速率填充物要用温水溶解,但温度不能太高,否则氯化铵受热分解。(3)把不溶性的固体与可溶性固体分离的操作是过滤。(4)①当1 mol MnO2参加反应时,共有4molC原子有反应前的+3价变为+4价。所以转移电子4mol。②根据电子守恒及质量守恒定律可得MnO(OH)与浓盐酸在加热条件下反应的化学方程式为2MnO(OH)+6HCl(浓)  2MnCl2+Cl2↑+4H2O。(5)铜帽溶解时加入H2O2的目的是为了溶解Cu单质。反应的方程式为Cu+H2O2+H2SO4=CuSO4+2H2O。铜帽溶解完全后,溶液中含有过量的H2O2。由于H2O2不稳定,受热容易发生分解反应产生氧气和水。所以可采用加热的方法除去溶液中过量的H2O2。(6)根据上图可知:①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率逐渐降低,当溶液的pH>11后又增加。即:先降低后升高。②在强酸性环境下Hg的吸收率高的原因可能是强酸性环境中KMnO4的氧化性强。
2MnCl2+Cl2↑+4H2O。(5)铜帽溶解时加入H2O2的目的是为了溶解Cu单质。反应的方程式为Cu+H2O2+H2SO4=CuSO4+2H2O。铜帽溶解完全后,溶液中含有过量的H2O2。由于H2O2不稳定,受热容易发生分解反应产生氧气和水。所以可采用加热的方法除去溶液中过量的H2O2。(6)根据上图可知:①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率逐渐降低,当溶液的pH>11后又增加。即:先降低后升高。②在强酸性环境下Hg的吸收率高的原因可能是强酸性环境中KMnO4的氧化性强。
本题难度:困难