1、选择题 下列说法中正确的是
A.1 mol·L-1的NaCl溶液是指此溶液中含有1 mol NaCl
B.从1L 0.5mol·L-1的NaCl溶液中取出10mL溶液,其物质的量浓度仍为0.5mol·L-1
C.1L水中溶解58.5g NaCl,该溶液中NaCl的物质的量浓度为1mol·L-1
D.1 mol·L-1的CaCl2溶液中,Cl-的物质的量浓度为1 mol·L-1
参考答案:B
本题解析:试题分析:A不正确,1 mol·L-1的NaCl溶液是指1L此溶液中含有1 mol NaCl。溶液是均一的、稳定的,所以B正确。C不正确,因为溶液的体积不是1L。D不正确,Cl-的物质的量浓度为2mol·L-1,答案选B。
考点:考查物质的量浓度溶液的有关计算
点评:该题是中等难度的试题,试题基础性强,注重解题的灵活性,有助于培养学生的逻辑推理能力以及灵活运用基础知识解决实际问题的能力。该题的关键是明确物质的量浓度溶液的含义。
本题难度:简单
2、实验题
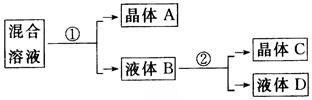
假设:①混合溶液中,n(KCl)=n(NaNO3);②盐类共存时不影响各自的溶解度。溶液中各种溶质在100℃和10℃的溶解度参照例题。试回答下列问题:
(1)①的主要操作是?;
②的主要操作是?。
(2)晶体A的主要成分是____________,若含有杂质可能是____________。晶体C的主要成分是____________,若含有杂质可能____________;通过实验确定晶体C中是否含有该杂质的方法是?。
(3)若晶体C中确实含有杂质,进一步提纯的方法是____________。
参考答案:(1)①蒸发水分,并将溶液控制在较高温度(如100℃)下,过滤析出晶体
②冷却至较低温度(如10℃),过滤析出晶体
(2)NaCl KNO3?KNO3?NaCl?用焰色反应检验是否含有Na+,用AgNO3(aq)和稀HNO3检验是否含有Cl-
(3)重结晶
本题解析:从含有4种离子:K+、Na+、Cl-和NO 的溶液中提取KNO3,应该采取冷却热饱和溶液的方法。而原溶液可能是不饱和的(对KNO3而言)、低温的。欲冷却,应制成高温的;欲使KNO3饱和,要蒸发水分——此为操作①。高温(100℃)下蒸发水,溶解度小者就会首先析出(NaCl)——此为A主要成分。过滤出NaCl晶体,然后冷却的饱和溶液——此即操作②,可析出晶体——主要是KNO3,也含有少量NaCl——C的主要成分。进行再结晶可提纯KNO3。
的溶液中提取KNO3,应该采取冷却热饱和溶液的方法。而原溶液可能是不饱和的(对KNO3而言)、低温的。欲冷却,应制成高温的;欲使KNO3饱和,要蒸发水分——此为操作①。高温(100℃)下蒸发水,溶解度小者就会首先析出(NaCl)——此为A主要成分。过滤出NaCl晶体,然后冷却的饱和溶液——此即操作②,可析出晶体——主要是KNO3,也含有少量NaCl——C的主要成分。进行再结晶可提纯KNO3。
本题难度:一般
3、填空题 欲除去下表中各粉末状混合物中的杂质(括号内为杂质),请填写所用的试剂、操作名称及化学方程式。
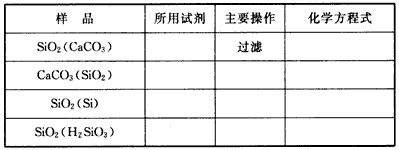
参考答案: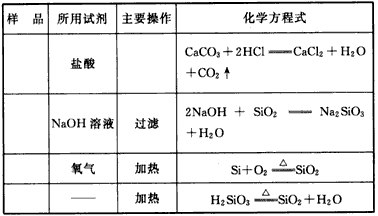
本题解析:
本题难度:一般
4、选择题 下列分离或提纯物质的方法正确的是
A.用渗析的方法精制Fe(OH)3胶体
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D.用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
参考答案:A
本题解析:A:正确;B:应采用渗析;C:BaSO4不溶于水或酸,所以BaCO3溶解后,过滤并不能得到纯净的BaCO3;D:一般采取沉淀的方法除去粗盐中的杂质;
本题难度:一般
5、选择题 下列有关离子的检验方法和判断正确的是
A.向某溶液中加入Na2CO3溶液,若有白色沉淀生成,证明一定含有Ca2+
B.向某固体中加入稀盐酸,产生了无色气体,证明该固体一定含有CO32—
C.向某溶液中滴加KSCN溶液,若溶液出现红色则说明原溶液中含Fe3+
D.向某溶液中先加稀硝酸,再加BaC12溶液,生成白色沉淀,证明一定含有SO42—
参考答案:C
本题解析:A、Ba2+、Mg2+等也能与碳酸钠溶液反应生成白色沉淀,错误;B、HCO3—等也能与稀盐酸反应放出无色气体,错误;C、只有Fe3+遇KSCN溶液变红,正确;D、Ag+或SO32—也能与稀硝酸、氯化钡反应生成白色沉淀,错误。
本题难度:一般