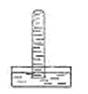
1、选择题 试管中充满某气体后倒立于盛水的水槽中,试管中立即充满液体,结果如图所示,该试管中原来所装的气体可能是(?)
A.CO2
B.NO
C.NH3
D.Cl2
参考答案:C
本题解析:试管中能充满溶液说明该气体能全部溶于该液体,或全部与该液体反应。A、CO2能溶于水,并与水反应生成碳酸,但不能完全反应,试管内压强减小,液面上升,但不充满整个试管,错误;B、NO不溶于水,也不与水反应,试管内压强不变,液面不变,错误;C、NH3极易溶于水,全部溶于水,试管内压强为零,试管中立即充满液体,正确;D、Cl2能溶于水,并与水反应,但不能完全反应,试管内压强减小,液面上升,但不充满整个试管,错误。
本题难度:一般
2、选择题 向一价金属的碘化物溶液中逐滴加入AgNO3溶液,直到沉淀完全为止。已知生成的新溶液的质量与原碘化物溶液的质量相等,则原AgNO3溶液的质量分数约为?
A.72%
B.54%
C.46%
D.28%
参考答案:A
本题解析:由题意可知:m(碘化物溶液)+m(AgNO3溶液)=m(AgI)+m(硝酸盐溶液),生成的新溶液的质量与原碘化物溶液的质量相等,
根据质量守恒,则有m(AgNO3溶液)=m(AgI),
设生成1molAgI,则AgNO3为1mol,
m(AgNO3)=170g,则ω(AgNO3)=m(AgNO3)/ m(AgI)×100%=170/235×100%≈72%,
故选A.
本题难度:一般
3、填空题 (10分)Ⅰ中国有广阔的海岸线,海水的综合利用大有可为,海水中溴含量约为65mg/L,从海水中提取Br2的工艺流程如下:

(1) 步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的?;
A.氧化性? B.还原性? C.挥发性? D.腐蚀性
(2) 请写出步骤Ⅱ中反应的离子反应方程式?;
(3) 实验室分离溴水中的溴还可以用萃取法,下列可以用作萃取剂的是?;
A.乙醇? B.四氯化碳? C.烧碱溶液? D.苯
Ⅱ?(1)目前世界上60%的镁单质是从海水中提取的。以下是海水中提炼金属镁的简易流程图(结合工业生产实际,在括号内填写需要加入物质的化学式,方框内填写生成物质的化学式)

(2)海带中含有碘离子,常用过氧化氢、稀硫酸和淀粉来检验其阴离子,其主要反应的离子方程式为?。
参考答案:Ⅰ(1)C?(2)3Br2+3CO32-====BrO3-+5Br-+3CO2↑?(3)BD?
Ⅱ
本题解析:I(1)利用热空气将溴吹出,不涉及化学反应,故应用的物理性质挥发性;(2)根据图示信息可得溴和碳酸钠反应生成了溴酸根离子和溴离子,根据原子守恒及反应原理分析还生成二氧化碳;(3)萃取剂必须满足的条件是与原溶剂不互溶,故排除AC,选BD;II(1)将镁离子转化为氢氧化镁,使镁富集,故需加入沉淀剂氧化钙,或氢氧化钙等;(2)酸性条件下碘离子被双氧水氧化为碘单质,淀粉检验碘单质的存在。
本题难度:一般
4、选择题 0.1mol某元素的单质直接与足量氯气反应,质量增加7.1g,这种元素可能是
(? )
A.Na
B.Al
C.Fe
D.Cu
参考答案:D
本题解析:由题意可知1mol 的金属可消耗1mol(相当于71g)的氯气,由化学方程式可知铜符合条件,故选D
本题难度:简单
5、计算题 将由CaCO3、MgCO3组成的混合物充分加热至质量不再减少时,称得残留物的质量为原混合物的一半,则残留物中Ca、Mg两元素原子的物质的量之比是多少?
参考答案:Ca、Mg两元素原子的物质的量之比为1:3.
本题解析:将CaCO3、MgCO3混合物加热时,发生反应:
CaCO3 CaO+CO2↑ MgCO3
CaO+CO2↑ MgCO3 MgO+CO2↑
MgO+CO2↑
则有:n(CaCO3)=n(CaO)?n(MgCO3)=n(MgO)
100 g·mol-1×n(CaO)+84 g·mol-1×n(MgO)=2×[56 g·mol-1×n(CaO)+40 g·mol-1×n(MgO)]
n(CaO):n(MgO)=1:3,所以N(Ca):N(Mg)=1:3.
本题难度:一般