1、填空题 铝及其化合物在生产生活中的应用非常广泛。铝合金材料的防腐、含铝食品或药品的使用等问题都备受关注。
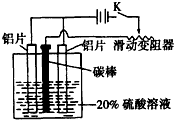
(1)铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中模拟该生产过程,实验装置如图所示。实验时接通开关K,通电约25min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:阳极:________________;
阴极:__________________。断开电路,取出铝片,用1%的稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式:________________。
(2)胃舒平(含有氢氧化铝)、平达喜都是常见的胃药。平达喜的化学成分是铝和镁的碱式碳酸盐。某化学兴趣小组通过以下实验探究该药物主要成分的化学式:甲同学取该碱式碳酸盐9.03 g充分灼烧至恒重, 测得剩余固体质量为5.13 g。乙同学取相同质量的碱式碳酸盐,使其溶于足量的盐酸中,收集到气体的 体积为336 mL(已换算成标准状况下);继续向其中加入足量的NaOH溶液,得到5.22 g白色沉淀。试通过计算确定该碱式碳酸盐的化学式(写出计算过程)。
参考答案:(1)2Al+3H2O-6e-=Al2O3+6H+;6H++6e-=3H2↑;NH3·H2O+H+=NH4++H2O?
(2)该碱式碳酸盐分解生成的水和CO2的总质量为9.03g-5.13g=3.9g,n(CO2)=0.015mol,m(CO2)=0.66g,
m(H2O)=3.9g-0.66g=3.24g,n(H2O) =0. 18mol。
该碱式碳酸盐受热分解所得到的固体是MgO和Al2O3的混合物。
n(MgO)=n[Mg(OH)2]=5.22g÷58g/mol=0. 09mol,m(MgO)=3.6g
m(Al2O3)=5.13g-3.6g=1.53g,n(Al2O3)=0.015mol
n(MgO):n(Al2O3):n(CO2):n(H2O)=0.09mol:0. 015mol:0. 015mol:0. 18mol=6:1:1:12,
所以该碱式碳酸盐的化学式为Mg6Al2(OH)16CO3·4H2O。
本题解析:
本题难度:一般
2、选择题 用铝箔包裹0.1?mol金属钠,用针扎出一些小孔,放入水中,完全反应后用排水集气法收集产生的气体,则收集到的气体为(标准状况)
[? ]
A.O2和H2的混合气体?
B.1.12?L?H2
C.大于1.12?L?H2?
D.小于1.12?L?H2
参考答案:C
本题解析:
本题难度:一般
3、选择题 某Mg-Al合金放入足量HCl溶液中,生成H2的体积在标准状况下是2240 mL,同质量该Mg-Al合金放入足量NaOH溶液中,生成H2的体积在标准状况下是2016 mL,则合金中Mg、Al的质量之比是
[? ]
A.1:1
B.6:1
C.1:6
D.4:27
参考答案:D
本题解析:
本题难度:一般
4、选择题 将11.5?g钠、9?g铝、28?g铁分别投入200?mL?1?mol/L的盐酸中,下列说法正确的是
[? ]
A.钠与盐酸反应最?剧烈,产生的气体最多
B.铝与盐酸反应的剧烈程度仅?次于钠,但产生的气体最多
C.铁与?盐酸反应产生的气体比钠多
D.反应结束时产生的气体一样多
参考答案:A
本题解析:
本题难度:一般
5、选择题 一定量的锌与100 mL 18.5 mol·L-1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6 L。将反应后的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1。则生成的气体中SO2和H2的体积比为
[? ]
A.1:4
B.4:1
C.1:2
D.2:1
参考答案:A
本题解析:
本题难度:一般