1、简答题 为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
探究一:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是______.
(2)称取碳素钢6.0g放入15.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y.
①甲同学认为X中除Fe3+之外还可能含有Fe2+.若要确认其中的Fe2+,应选用______(选填序号).
A.KSCN溶液和氯水?B.铁粉和KSCN溶液?C.浓氨水?D.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g.由此推知气体Y中SO2的体积分数为______.
探究二:
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g?L-1.为此设计了下列探究实验装置(假设有关气体完全反应).

(3)装置B中试剂的作用是______
(4)分析Y气体中的Q2气体是如何生成的______(用化学方程式表示).
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于______(填序号).
A.A之前?B.A-B间?C.B-C间?D.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是______.
参考答案:(1)常温下,铁遇冷的浓硫酸发生氧化还原反应,在铁表面生成一层致密的氧化物薄膜而阻止了进一步的反应,即发生钝化现象,所以反应片刻后取出观察,铁钉表面无明显变化,
故答案为:铁在冷的浓硫酸中钝化,表面生成致密氧化膜;
(2)①亚铁离子具有还原性,而酸性高锰酸钾有氧化性,发生氧化还原反应使高锰酸钾溶液褪色,故选D;
②SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,所以硫酸钡和二氧化硫之间的关系式为SO2-----BaSO4,设二氧化硫的体积为V,
SO2-----BaSO4,
22.4L? 233g
V? 4.66g
V=0.448l=448mL,所以二氧化硫的体积分数=448mL560mL×100%=80%,
故答案为:80%;
(3)二氧化硫能使品红溶液褪色,所以用品红溶液检验二氧化硫是否除尽,故答案为:确认二氧化硫已经除尽;
(4)碳素钢中含有碳,加热条件下,碳能和浓硫酸反应生成二氧化硫、二氧化碳和水,反应方程式为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O;
(5)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,但二氧化硫还能使品红溶液褪色,所以要检验二氧化碳必须排除二氧化硫的干扰,B装置是检验二氧化硫是否除尽,所以澄清石灰水应放置在B和C之间,故选C;
(6)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色,这是检验水的特征反应,所以如果D中氧化铜变红,E中无水硫酸铜变蓝,则证明含有氢气,故答案为:D中氧化铜变红,E中无水硫酸铜变蓝.
本题解析:
本题难度:一般
2、选择题 下列气体中不能用浓硫酸干燥的是( )
A.O2
B.CO2
C.NH3
D.SO2
参考答案:浓硫酸具有强氧化性和酸性,则NH3不能用浓硫酸干燥,可与硫酸反应生成硫酸铵,而其它气体与浓硫酸不反应,可用浓硫酸干燥.
故选C.
本题解析:
本题难度:一般
3、选择题 通过对实验的观察、分析推理、得出正确的结论是化学学习的主要方法之一.对下列实验事实或现象的解释正确的是( )?
A.KI淀粉溶液中通入Cl2,溶液变蓝原因是淀粉能与Cl2发生显色反应?
B.浓硝酸在光照条件下变黄是由于浓硝酸不稳定,生成有色物质能溶于浓硝酸?
C.某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成说明该溶液中含有SO42-
D.常温下,浓硫酸可储存在铁质或铝制器皿中说明常温下铁和铝与浓硫酸不反应?
参考答案:A.KI淀粉溶液中通入Cl2,生成I2,淀粉遇I2变蓝色,氯气和淀粉不反应,故A错误;
B.浓硝酸在光照条件下分解生成NO2,NO2溶于水而导致溶液变黄,故B正确;
C.SO32-可被硝酸氧化为SO42-,不能判断一定含有SO42-,故C错误;
D.铁和铝与浓硫酸发生钝化反应,故D错误.
故选B.
本题解析:
本题难度:简单
4、选择题 在下图所示的实验装置中,从实验开始到过一段时间后,对观察到的现象叙述不正确的是
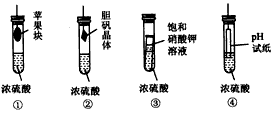
[? ]
A.①中苹果块会干瘪
B.②中胆矾晶体表面有“白斑”
C.③中小试管内有晶体析出
D.④中pH试纸变红
参考答案:D
本题解析:
本题难度:简单
5、选择题 从下列实验事实所引出的相应结论正确的是
A.A
B.B
C.C
D.D
参考答案:A
本题解析:分析:A.反应物浓度越大,反应速率越大;
B.化学反应中,催化剂参与反应过程;
C.醋酸为弱酸,不能完全电离;
D.增大压强,正逆反应速率都增大.
解答:A.当其他条件不变时,增大反应物浓度,活化分子的浓度增大,有效碰撞的次数增多,则反应速率增大,故A正确;
B.化学反应中,催化剂参与反应过程,降低反应的活化能,加快反应速率,但反应前后催化剂的质量和性质不变,故B错误;
C.醋酸为弱酸,不能完全电离,氢离子浓度相同时,醋酸浓度大,与足量的锌反应,生成氢气体积大,故C错误;
D.增大压强,正逆反应速率都增大,故D错误.
故选A.
点评:本题考查较为综合,涉及影响反应速率的实验探究、弱电解质的电离以及催化的作用,题目难度不大,注意相关基础知识的积累.
本题难度:简单