|
高中化学知识点总结《离子共存》考点特训(2019年冲刺版)(四)
2019-06-25 22:46:36
【 大 中 小】
|
1、选择题 某溶液里存有NH4+ Fe3+ Cu2+ Cl- SO42-离子,溶液不浑浊的是 ( )
A.CuCl2 NH4Cl Fe2(SO4)3 NaNO3
B.(NH4)2SO4 CuSO4 Na2CO3 FeCl3
C.Cu(NO3)2 NH4 NO3 FeCl3 H2S
D.Ba Cl2 Cu(NO3)2 (NH4)2SO4 Fe (NO3)3
|
参考答案:A
本题解析:略
本题难度:一般
2、填空题 (8分)某工业废水中,除H+、OH-外仅含下表离子中的几种。
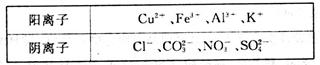
甲同学欲探究废水的组成,进行了如下实验:
I.取少量废水样品,加入KSCN溶液无明显变化。
II.另取少量废水样品,逐滴加入NaOH溶液,产生沉淀,继续滴加过量的NaOH溶液,沉淀部分溶解。
请回答下列问题:
(1)废水中一定含有的金属阳离子是___________(填离子符号)。
(2)Ⅱ中沉淀部分溶解过程中发生反应的离子方程式是____________________________。
(3)甲同学通过分析最终确定废水中一定不能大量存在上表所列四种阴离子中的________(填离子符号),其判断理由是_________________________________________。
参考答案:(每空2分,共8分)(1)Al3+ Cu2+ (2)Al(OH)3 + OH-= [Al(OH)4]-
(3)CO32- Al3+与CO32-在水溶液中同时发生水解且两个水解过程相互促进,故废水中不能大量存在CO32-。(或Cu2+与CO32-结合生成CuCO3沉淀,故废水中不能大量存在CO32-。)
本题解析:(1)取少量废水样品,加入KSCN溶液无明显变化,说明不存在铁离子;另取少量废水样品,逐滴加入NaOH溶液,产生沉淀,继续滴加过量的NaOH溶液,沉淀部分溶解,这说明产生的沉淀是氢氧化铝和氢氧化铜,所以废水中一定含有的金属阳离子是Al3+ Cu2+。
(2)氢氧化铝溶解的离子方程式是Al(OH)3 + OH-= [Al(OH)4]-。
(3) 由于Al3+与CO32-在水溶液中同时发生水解且两个水解过程相互促进,故废水中不能大量存在CO32-。
考点:考查离子共存与离子检验的有关判断
本题难度:困难
3、选择题 在某透明的强酸性溶液中,能大量共存的无色离子组是( )
A.K+、Na+、Cu2+、SO42-
B.Na+、Al3+、Cl-、NO3-
C.Na+、K+、CO32-、Cl-
D.K+、SO42-、Cl-、Ba2+
参考答案:A.该组离子之间不反应,能共存,但Cu2+在溶液中为蓝色,与无色溶液不符,故A不选;
B.该组离子之间不反应,能共存,且离子均为无色,故B选;
C.因H+、CO32-结合生成水和气体,则不能共存,故C不选;
D.因SO42-、Ba2+能结合生成硫酸钡沉淀,则不能共存,故D不选;
故选B.
本题解析:
本题难度:简单
4、选择题 既可以在强酸性条件下大量共存又能在强碱性条件下大量共存的离子组是( )
A.Al3+Na+NO3-Cl-
B.K+Na+Cl-NO3-
C.K+Na+Cl-AlO2-
D.K+HCO3-SO42-NO3-
参考答案:A.碱溶液中不能大量存在Al3+,故A错误;
B.无论酸或碱溶液中,该组离子之间均不反应,能大量共存,故B正确;
C.酸溶液中不能大量存在AlO2-,故C错误;
D.HCO3-既能与酸反应又能与碱反应,不能大量共存,故D错误;
故选B.
本题解析:
本题难度:简单
5、选择题 在无色透明的强酸性溶液中,能大量共存的是( )
参考答案:A
本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。溶液是无色的,而铜离子在溶液中是蓝色,所以C不能大量共存;由于溶液显酸性,则A中离子能大量共存;B中能产生碳酸钙沉淀,D中能产生硫酸钡沉淀,所以答案选A。
本题难度:一般
|