1、填空题 在一密闭容器中,发生可逆反应 aA(g)+bB(g) cC(g)+dD(g) 试据图回答
cC(g)+dD(g) 试据图回答
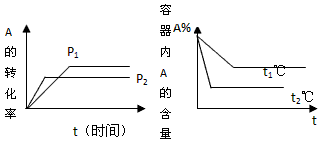
(1)压强P1_____P2,a+b______c+d (填<、>、=)?
(2)温度t1℃比t2℃_______(填高或低), 正方向为________反应。(填放热或吸热)
参考答案:(1)<;<
(2)低;吸热
本题解析:
本题难度:一般
2、选择题 对于反应X(g)+Y(g)═2Z(g)△H<0,下列有关说法错误的是( )
A.反应达到平衡后,加入催化剂,Z的产率不变,反应速率增大
B.反应达到平衡后,若降低温度,Y的转化率增大
C.若反应在固定的密闭容器中进行,当压强不再变化时,反应达到平衡状态
D.反应达到平衡后,增大c(X),平衡右移,K值不变
参考答案:A、催化剂改变反应速率不改变化学平衡,Z的产率不变,反应速率增大,故A正确;
B、反应是放热反应,降低温度平衡逆向进行,Y的转化率减小,故B正确;
C、反应前后气体体积不变,压强改变平衡不动,反应过程中和平衡状态气体压强都不变,故C错误;
D、反应达到平衡后,增大c(X),平衡右移,平衡错的只随温度变化,不随浓度变化,则K值不变,故D正确;
故选C.
本题解析:
本题难度:一般
3、选择题 在一容积固定的密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+ B(g) 2C(g);
2C(g);
△H<0 当达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是

[? ]
x
y
A.
温度
混合气体的密度
B.
再加入B
A的物质的量
C.
再加入A
A的转化率
D.
压强
C的百分含量
参考答案:D
本题解析:
本题难度:一般
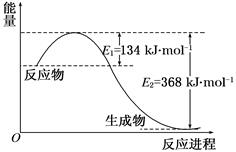
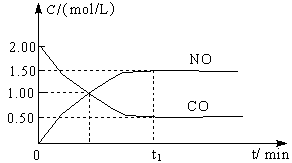
4、填空题 图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
a b
(1)写出NO2和CO反应的热化学方程式 。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)= 。
(3)此温度下该反应的平衡常数K= ;温度降低,K (填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡
参考答案:
本题解析:
本题难度:困难
5、填空题 (13分)(1)对于下列反应:2SO2 + O2?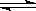 ?2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
?2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
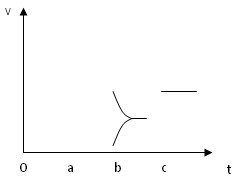
(2)下图表示在密闭容器中反应:2SO2+O2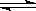 2SO3?△H<0?达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
2SO3?△H<0?达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。

①a b过程中改变的条件可能是?;
②b c过程中改变的条件可能是?;
③若加入催化剂,请将反应速度变化情况画在c~d处。
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅黄绿色消失,溶液变成稀盐酸:?
参考答案:(1)2mol/(L·min); 1mol/(L·min);(各两分,其中数值错没分,没单位扣一分)
(2)升温;减小SO3浓度;(各一分)
 (图1分)
(图1分)
(3)在氯水中存在平衡:Cl2+H2O 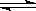 ?HCl + HClO ,HClO见光易分解为HCl和O2,使得平衡体系中HClO浓度减小,平衡向正反应方向移动,Cl2浓度减小.HCl浓度增大,最后浅绿色消失,溶液变成稀盐酸.(3分)
?HCl + HClO ,HClO见光易分解为HCl和O2,使得平衡体系中HClO浓度减小,平衡向正反应方向移动,Cl2浓度减小.HCl浓度增大,最后浅绿色消失,溶液变成稀盐酸.(3分)
本题解析:(1)υ(SO2)=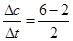 =2mol/(L·min),υ(SO2)=
=2mol/(L·min),υ(SO2)= ×υ(SO2)=1mol/(L·min)
×υ(SO2)=1mol/(L·min)
(2)①a b过程中正逆反应速率均增大,且平衡逆向移动,应该是升温
②b c过程中逆反应速率瞬间减小,平衡正向移动,应该是减小了产物浓度
③若加入催化剂,正逆反应速率同倍数增大
(3)见答案
本题难度:一般